THEosmóza a průchod rozpouštědlem, z méně koncentrovaného roztoku do koncentrovanějšího roztoku, a Semipermeabilní membrána, dokud tlak vyvíjený roztokem na membránu nezabrání průchodu rozpouštědla. Tento proces je určen k vyrovnejte koncentraci roztoku.
Přečtěte si také: Rozpuštěná látka a rozpouštědlo
osmotický tlak
THE osmotický tlak a tlak vyvíjený na roztok s vyšší koncentrací takže nedochází k osmóze, to znamená, aby rozpouštědlo neprocházelo polopropustnou membránou.
Osmotický tlak se používá v procesech odsolování vody, nutit proces reverzní osmóza, což způsobilo, že rozpouštědlo přešlo z koncentrovanějšího roztoku do méně koncentrovaného. Tento proces nazýváme reverzní osmóza. Podívejte se na následující obrázek, který porovnává dva procesy:
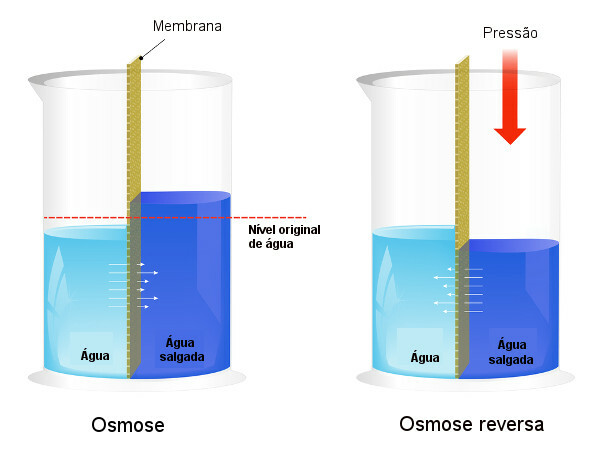
Všimněte si, že v osmóze je průchod rozpouštědla ve směru nejkoncentrovanějšího roztoku a že v reverzní osmóze je průchod v opačném směru v důsledku aplikovaného tlaku. Chcete-li se o tématu dozvědět více, přečtěte si náš text:
osmotický tlak.Vědět více: Reverzní osmóza při odsolování mořské vody
rovnice osmotického tlaku
Osmotický tlak, představovaný písmenem pi (π) řešení lze vypočítat podle následující rovnice:
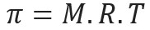
M = koncentrace v mol / l
R = univerzální konstanta dokonalých plynů
T = absolutní teplota v K
jako ostatní Koligativní vlastnosti, osmotický tlak závisí na koncentrace roztoku, to znamená, že čím větší je koncentrace roztoku, tím větší je účinek osmózy na roztoky, a proto je větší osmotický tlak.
Příklady
Osmóza se v našem každodenním životě objevuje v různých dobách. Můžeme uvést příklad proces solení masa tvému zachování. Vy mikroorganismy to by způsobilo degradaci masa ztratit voduzevnitř ven, který má koncentraci soli, takže jídlo vydrží déle.
Kvůli soli se také stává, že listy salátu chřadnou za ztrátu vody zevnitř jejich buňky (druh méně koncentrovaného) pro temperované řešení ve vnějším prostředí.
Osmóza je také důležitá, když mluvíme o krev člověk. Říkáme, že Červené krvinky a krev je jedna izotonické médium, to znamená, že mají stejný osmotický tlak, což umožňuje snadný vstup a výstup vody z buňky.
Pokud se však krev stane méně koncentrovanou než uvnitř červených krvinek (hypotonické médium), k průchodu vody dojde uvnitř buňky snadněji, čímž dojde k jejímu průniku bobtnat, dokud nepraskne. Pokud krev dosáhne koncentrace vyšší než je koncentrace červených krvinek (hypertonického média), krvinky vadnou, protože ztrácejí vodu.

Ze stejného principu ochrany masa platí: ochrana ovocev cukrovinkách, kteří konzervují jídlo kvůli vysoká koncentrace cukru v řešení.
Následují další příklady, kde dochází k osmóze:
- ve vznosu mízy ve vodivých nádobách rostliny;
- na hemodialýza;
- při selektivním průchodu živin v buňkách lidského těla.
Chcete-li pochopit, jak se osmóza děje ve zvířecí buňce, rostlinné buňce a dalších biologických problémech, přečtěte si: Osmóza: co to je a jak se vyskytuje v živočišné a rostlinné buňce.
Autor: Victor Ferreira
Učitel chemie

