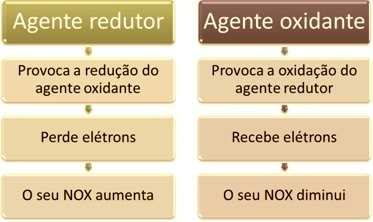
Jedním z hlavních rysů, které odlišují oxidačně-redukční reakci (nebo redox) ostatních je přítomnost oxidačního činidla a redukčního činidla, které lze definovat takto:
Podívejte se například na chemickou reakci níže, kde hliník (Al) koroduje ve vodném roztoku kyseliny chlorovodíkové (HCl). Atomy hliníku přenášejí elektrony na H. kationty+(tady) a vyrábět Al kation3+(tady):
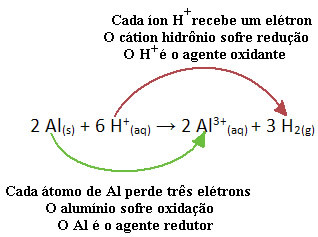
Všimněte si, že protože Al přenesl elektrony, znamená to, že způsobil redukci kationtů H.+(tady); proto je povolán redukční činidlo. Již kation H+(tady) odstranil elektrony z hliníku, způsobující oxidaci toho kovu; proto se chová jako oxidační činidlo.
V každodenním životě existuje mnoho příkladů výkonu oxidačních činidel a redukčních činidel. Podívejte se na některé z nich a nezapomeňte, že ke redukci dochází ve všech případech současně s oxidací; proto, pokud existuje redukční činidlo, existuje také oxidační činidlo.
- Příklady redukčních činidel:
- Ve fotografických filmech: fotografické filmy obsahují soli stříbra citlivé na světlo. V místech s dopadem světla dochází ke snížení iontů Ag +, což má za následek kontrast pozorovaný u negativů.

- Vitamín C: Vitamin C (kyselina L-askorbová) je silné redukční činidlo ve vodném roztoku. Má výjimečnou schopnost oxidace, a proto je široce používán, zejména v potravinách, jako je a antioxidant, to znamená, že se přidává do jiných potravin a chrání je před možnou oxidací díky své vlastní oběť. Příkladem je ovoce, jako jsou jablka a hrušky, které při kontaktu s kyslíkem ve vzduchu ztmavnou, protože oxidují. Ale když do ovoce přidáte malé množství pomerančové nebo citronové šťávy (které obsahují vitamin C) řez, to zabrání této reakci, protože vitamin C působí jako redukční činidlo a oxiduje před ovocem.

- Plynný vodík: plynný vodík (H2) se používá v raketovém pohonu a je považován za jednu z nejdůležitějších alternativ energie, protože při jejím spalování se uvolňuje velké množství energie a žádné znečišťující látky. Při této reakci působí vodík jako redukční činidlo a je oxidován kyslíkem.
- Příklady oxidačních činidel:
- Při výrobě octa: když je víno vystaveno vzduchu, změní se na ocet, jehož hlavní složkou je kyselina octová. Důvodem je to, že ethylalkohol nebo ethanol přítomný ve víně oxiduje při kontaktu s atmosférickým kyslíkem, což vede k kyselině octové. Kyslík je tedy oxidační činidlo. I původ termínu „oxidace“ souvisí s reakcí s kyslíkem.

- V rzi: jak je uvedeno v předchozím příkladu, kyslík působí jako oxidační činidlo pro alkohol; a to také při kontaktu s různými kovy, jako je železo, což způsobuje proces koroze. Kromě kyslíku ve vzduchu jsou v tomto případě dalšími oxidačními činidly voda nebo kyselý roztok.
- V bělidlech: bělící účinek bělících prostředků je způsoben přítomností následujících dvou redukčních činidel: o chlornanový anion (obvykle ve formě sodné soli - NaOCl), přítomný například v bělidle; a peroxid vodíku (H2Ó2), prodávaný jako peroxid vodíku. Tyto dvě sloučeniny mají velmi silnou tendenci oxidovat a způsobovat redukci dalších chemických látek. Proto jsou odpovědné za oxidaci látek, které dodávají produktům tmavou barvu. Například v celulóze se lignin rozkládá a stává se lehčí a tvárnější. V případě odstraňování skvrn a bělení tkanin způsobují tato oxidační činidla oxidaci organických molekul, jako jsou tuky a barviva.

- V analyzátorech alkoholu: jednoduchý jednorázový dechový analyzátor sestává z čiré zkumavky obsahující vodný roztok dichromanové soli draslíku a oxidu křemičitého, zvlhčený kyselinou sírovou; smíchané s oranžovou barvou. Tato sůl při kontaktu s alkoholovými parami obsaženými v dechu opilého řidiče reaguje a mění barvu na zelenou. To znamená, že je způsobena oxidace ethanolu (alkoholu) na ethanal.

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm
