Iontová vazba nastává mezi ionty, jak naznačuje její název. Protože mají opačné náboje, kationty (prvek s kladným nábojem) a anionty (prvek se záporným nábojem) se navzájem elektrostaticky přitahují a vytvářejí vazbu. Iontová pevná látka je však tvořena aglomerátem kationtů a aniontů uspořádaných do přesně definovaných geometrických tvarů, nazývaných mřížky nebo krystalické mřížky.
Například sůl (chlorid sodný) vzniká definitivním přenosem elektronu ze sodíku na chlor, což vede ke vzniku kationtu sodíku (Na+) a chloridový anion (Cl-). V praxi tato reakce zahrnuje nejen dva atomy, ale enormní a neurčitý počet atomů, které tvoří krychlovou krystalickou mříž, jak je znázorněno níže:
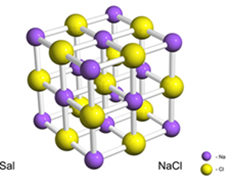
Podíváme-li se na krystaly soli pomocí rastrovacího elektronového mikroskopu, zjistíme, že jsou ve skutečnosti kubické kvůli své vnitřní struktuře.

Jelikož je každá iontová sloučenina tvořena neurčitým a velmi velkým počtem iontů, jak můžeme představovat iontovou sloučeninu?
Obvykle se používá vzorec jednotkový vzorec
, což je ten, který představuje podíl vyjádřený nejmenším možným počtem kationtů a aniontů, které tvoří krystalickou mřížku, takže celkový náboj sloučeniny je neutralizován. K tomu je nutné, aby se počet elektronů vzdaných atomem rovnal počtu elektronů přijatých druhým atomem.Některé aspekty jednotkového vzorce iontových sloučenin jsou důležité, viz některé:
- Vždy nejprve napište kation a poté anion;
- Protože každá iontová sloučenina je elektricky neutrální, není nutné jednotlivé iontové náboje zapisovat;
- Čísla dolního indexu, která se objevují na pravé straně každého iontu, označují poměr atomů kationtu k aniontu. Tato čísla se nazývají indexy a číslo 1 není zapsáno.
Například v případě chloridu sodného máme jednotkový vzorec NaCl, protože pro každý chloridový anion máme přesně 1 kationt sodný.
Viz další příklad Al3+ má tři kladné náboje, zatímco F- má pouze jeden negativní, takže k neutralizaci sloučeniny jsou zapotřebí tři fluoridové anionty. Došli jsme tedy k závěru, že její jednotkový vzorec je AlF3.
Jednoduchý způsob, jak dospět k jednotkovému vzorce iontové sloučeniny, je vyměnit své náboje za své indexy, jak je ukázáno níže:
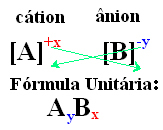
Příklady:

Další vzorec používaný k označení iontových látek je Lewisův vzorec nebo elektronický vzorec, co představuje elektrony z valenčního pláště iontů „koulí“ kolem symbolu prvku. V případě soli máme:

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm


