Kapacita, kterou musí připojení přitahovat elektrické náboje, je definována jako polarita, která nabývá jiného charakteru v závislosti na připojení, kde je přítomno.
Nejčastější vazby zahrnující organické sloučeniny se vyskytují mezi atomy uhlíku nebo mezi atomy uhlíku a vodíku: C ─ C a C ─ H (uhlovodíky). Tento typ vazby klasifikujeme jako kovalentní, je přítomen ve všech vazbách organických sloučenin tvořených pouze uhlíkem a vodíkem.
Když je v molekule organické sloučeniny kromě uhlíku a vodíku ještě další chemický prvek, jeho molekuly budou mít určitou polaritu. Tento prvek nazýváme heteroatom a může to být mimo jiné dusík (N), kyslík (O).
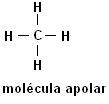
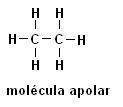
Metan (CH4) Ethan (C.2H6)
Všimněte si, že v obou strukturách není přítomnost heteroatomů, v tomto případě jsou molekuly klasifikovány jako nepolární.


Přítomnost kyslíku jako heteroatomu způsobuje, že molekuly vykazují polaritu. První molekulou je sloučenina Ethanol (CH3CH2Ach), přítomnost hydroxy-OH dává této sloučenině polární charakter, i když ve své struktuře obsahuje nepolární část.
Líria Alves
Vystudoval chemii
Tým brazilské školy
Vidět víc! plochý izomer
Organická chemie - Chemie - Brazilská škola
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm
