Ó Schrödingerův atomový model je běžná forma používaná k označení popis atomu řešením Schrödingerovy rovnice, kterou navrhl rakouský fyzik Erwin Schrödinger v roce 1927. Rovnice je koncipována na základě důležitých pozorování získaných v rámci kvantové mechaniky a přináší robustní zdůvodnění energie atomu a elektronu.
Atom koncipovaný Schrödingerem je založen na dualitě vlna-částice, na principu neurčitosti, mezi jinými pojmy vytvořenými na počátku 20. století. Přineslo to velký pokrok v chápání hmoty, protože připravilo cestu pro pevnější pochopení polyelektronických atomů, což není možné s atomovým modelem navrženým Bohrem.
Čtěte také: Atomové modely — modely navržené k vysvětlení struktury atomu
Témata tohoto článku
- 1 - Shrnutí Schrödingerova atomového modelu
- 2 - Co je Schrödingerův atomový model?
-
3 - Experimentální základ pro Schrödingerův atomový model
- Fotoelektrický jev
- dualita vlna-částice
- princip neurčitosti
- 4 - Charakteristika Schrödingerova atomového modelu
- 5 - Pokroky Schrödingerova atomového modelu ve vztahu k jiným atomovým modelům
Shrnutí o Schrödingerově atomovém modelu
Schrödingerův atomový model je vlastně popis atomu a elektronů pomocí Schrödingerovy rovnice.
Schrödingerova rovnice byla vyvinuta prostřednictvím důležitých studií v oblasti kvantové mechaniky.
Dualita vlna-částice, princip neurčitosti, kromě jiných teorií, byly zásadní pro vytvoření Schrödingerovy rovnice.
Řešením Schrödingerovy rovnice je možné popsat energii atomu i energii elektronu.
Na základě výkladu Schrödingerovy rovnice lze vidět, že elektrony nemají určitá orbita kolem atomu, ale spíše oblast pravděpodobnosti existence kolem od něho.
Schrödingerovy studie rozšiřují porozumění atomu navržené Bohrem, protože umožňují pochopení chování polyelektronických atomů.
Jaký je Schrödingerův atomový model?
Schrödingerův atomový model je společný název pro popis modelu atomu založeného na kvantové mechanice. Hlavní charakteristikou tohoto modelu je matematická interpretace duality vlna-částice přijatá elektrony, více konkrétně nahrazení dobře definované trajektorie elektronu pravděpodobností existence elektronu kolem jádro.
Taková interpretace začala díky práci rakouského vědce Erwina Schrödingera v roce 1927, po významném pokroku v chápání hmoty v oblasti kvantové mechaniky, jako je fotoelektrický jev, princip neurčitosti a dualita vlna-částice.
Pochopení Schrödingerova atomového modelu není triviální, přistupuje se k němu na pokročilejších úrovních studia chemie.
Nepřestávej teď... Po publicitě je toho víc ;)
Experimentální základ pro Schrödingerův atomový model
Před studiem Erwina Schrödingera došlo k důležitým pokrokům v chápání hmoty na počátku 20. století. Takové experimenty iniciovaly oblast teoretických znalostí známou jako kvantová mechanika, která přináší interpretace o chování částic blízko nebo pod atomovým měřítkem. V tomto specifickém vesmíru zákony klasické fyziky, známé také jako newtonovská fyzika, často neplatí nebo nestačí k vysvětlení určitého chování.
Jen pro představu můžeme říci, že kvantová mechanika začíná tématem známým jako ultrafialová katastrofa. Podle klasické fyziky černé těleso (žhavý předmět), s teplotou odlišnou od nuly, vyzařuje kromě gama záření a rentgenového záření intenzivní ultrafialové záření.
To znamená, že my lidé bychom se svou teplotou 36-37 °C ve tmě svítili (důsledek žhavení). Netřeba dodávat, že je to úplný nesmysl, protože kdyby tomu tak bylo, nebyla by žádná tma.
V tomto kontextu, V roce 1900 vytvořil Max Planck koncept jak moc, přeloženo jako „balíčky energie“, aby se vysvětlila výměna energie mezi hmotou a zářením. Podle jeho výkladu nemá těleso při nízkých teplotách (jako my) dostatek energie k vyzařování vysokofrekvenčního ultrafialového záření.
Těleso tedy může vysílat vysokofrekvenční ultrafialové záření pouze tehdy, když získá minimální potřebnou energii. V tomto stavu dochází k výměně energie mezi hmotou a okolím prostřednictvím balíčků energie záření.
Energetické balíčky také přinášejí rozdíl ve vztahu ke klasické fyzice. Když mluvíme o balíčcích energie, odkazuje se na energii, která je kvantovaná, tedy je specifický, dochází k uvalení limitů. V newtonovské fyzice nemá množství energie vyměněné mezi dvěma objekty žádná omezení.
Fotoelektrický jev
Aby byly teorie navržené Planckem robustní, bylo zapotřebí více důkazů. V této souvislosti se objevil fotoelektrický jev., která se zabývá vypuzováním elektronů z kovu prostřednictvím dopadu ultrafialového záření na jeho povrch.
Podle pozorování této teorie nejsou žádné elektrony vyvrženy, dokud záření nedosáhne frekvence určité hodnoty, specifické pro každý kov. Jakmile je této frekvence dosaženo, elektrony jsou okamžitě vyvrženy a čím intenzivnější je frekvence dopadajícího záření, tím rychlejší bude mít vyvržený elektron.
A vysvětlení pro fotoelektrický jev podal Albert Einstein. Podle Einsteina se elektromagnetické záření (např. světlo je elektromagnetické záření), používané k vymršťování elektronů, skládalo z částice známé jako fotonya navíc by každý foton mohl být interpretován jako balíček energie. Na základě Planckových studií bylo možné dojít k závěru, že fotony ultrafialového záření jsou energetičtější než fotony viditelného světla.

Při srážce s povrchem kovu si fotony (složky elektromagnetického záření) vyměňují energii s tam přítomnými elektrony. Pokud je energie absorbovaná elektronem při srážce s fotony dostatečně velká, bude vyvržen. Chcete-li se dozvědět více o fotoelektrickém jevu, klikněte tady.
dualita vlna-částice
Fotoelektrický jev přinesl silný základ, že elektromagnetické záření je složeno z částic (fotonů). Mnoho dalších experimentů však ukázalo, že elektromagnetické záření se chová jako vlna. Z těchto experimentů byla nejpozoruhodnější difrakce — fyzikální jev pozorovaný, když vlna narazí na překážku nebo podle jiného výkladu na schopnost vln překonávat překážky.
Ó Vlnový charakter světla je znám již od roku 1801, kdy anglický fyzik Thomas Young posvítil na závoru se štěrbinou. Když světlo prochází touto štěrbinou, podléhá difrakci. V každé štěrbině, včetně té, kterou světlo prochází, i když je ohnuto, prochází novou difrakcí.

Takhle, bylo nutné přijmout nové chování pro elektromagnetické záření: dualita vlna-částice. Odtud francouzský vědec Louis de Broglie rozšířil tento koncept a navrhl, že všechny částice by také měly být chápány jako částice s vlnovým chováním.
De Broglieho hypotéza nabyla na síle v roce 1925, kdy američtí vědci Clinton Davisson a Lester Germer prokázal, že elektronový paprsek byl schopen podstoupit difrakci při průchodu monokrystalem nikl.
Toto vnímání bylo zásadní pro dosažení závěru, že těžší částice, jako jsou molekuly, jsou také schopné podléhat difrakci, a tudíž vykazovat vlnové chování. Chcete-li se dozvědět více o dualitě vlna-částice, klikněte tady.
princip neurčitosti
V klasické fyzice je pro vás snadné určit dráhu částice. V kvantovém světě, ve kterém se částice také chovají jako vlny, však již není jejich trajektorie tak přesná. To proto nemá smysl mluvit o umístění vlny.
Například na kytaře, když zabrnknete na strunu, vlna se roztáhne po celé její délce. Pokud má částice stejné chování, neexistuje způsob, jak přesně definovat její umístění, dokonce ani znát jeho lineární hybnost (množství, které mísí hmotnost a rychlost).
Proto elektron, který má také duální charakter, nemá definovanou dráhu/cestu kolem atomového jádra, jak se mnozí domnívají. Adualita pak vytváří nejistotu ohledně přesné polohy částice.
Tato nejistota v definici polohy je zanedbatelná u velmi těžkých těles, ale plně významná pro tělesa atomové velikosti resp. subatomární, to znamená, že pokud víte, že částice je na určitém místě, v určitém okamžiku už nebudete vědět, kde bude v dalším okamžitý.
Z tohoto dilematu vznikl princip neurčitosti., kterou založil německý fyzik Werner Heisenberg v roce 1927. Podle tohoto principu není možné znát polohu a lineární hybnost částice bez meze chyby, to znamená, že pokud je známa jedna vlastnost, druhá ne. Chcete-li se dozvědět více o principu nejistoty, klikněte tady.
Vlastnosti Schrödingerova atomového modelu
Protože z duálního charakteru částice již nebylo možné definovat pro ni konkrétní trajektorii, v roce 1927 rakouský vědec Erwin Schrödinger nahradil tuto přesnou trajektorii vlnovou funkcí, reprezentovaný řeckým písmenem psi (ψ), přičemž hodnoty této funkce se liší podle polohy. Příkladem vlnové funkce je sinusová funkce X.
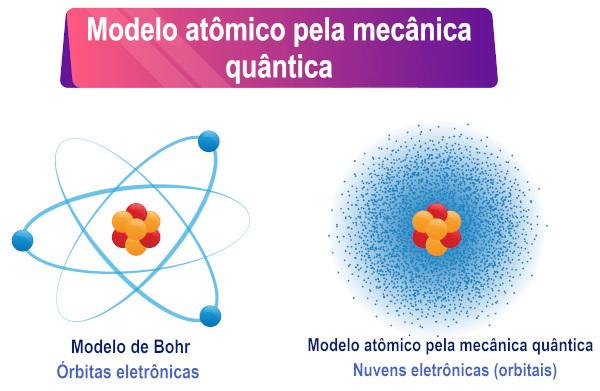
Vědec Max Born poté vytvořil fyzikální interpretaci vlnové funkce a uvedl, že Druhá mocnina funkce ψ, tedy ψ², by byla úměrná pravděpodobnosti nalezení částice v kraj. ψ² je tedy chápána jako hustota pravděpodobnosti nalezení částice v nějaké oblasti. Protože se jedná o hustotu pravděpodobnosti, musí být hodnota ψ² vynásobena objemem, abychom získali skutečnou pravděpodobnost.
Pro výpočet vlnové funkce vyvinul Schrödinger rovnici, zjednodušeně takto:
Hψ = Eψ
Hψ by se mělo číst jako „hamiltonián psi“ a popisuje zakřivení vlnové funkce. Hamiltonián je matematický operátor, stejně jako plus, mínus, log atd. Pravá strana nám přináší odpovídající energii.
Řešení této rovnice nám přináší důležitý závěr: částice mohou mít pouze diskrétní energies, to znamená dobře určené energie, nebo kvantované, a ne jakákoliv hodnota. Tyto specifické energetické hodnoty jsou známé jako energetické hladiny. Toto je uložení vlnové funkce, protože se musí vejít do určité oblasti prostoru. V klasické mechanice může mít předmět jakoukoli hodnotu celkové energie.
Takhle, elektron nemůže mít žádnou energii, ale dobře definované energetické hladiny. Protože vlnová funkce musí odpovídat oblasti prostoru, pamatujte, že a elektron je uzavřen uvnitř atomu prostřednictvím přitažlivých sil, které má pro jádro.
Energetické hladiny atomu lze vypočítat vhodným řešením Schrödingerovy rovnice. V tomto případě si všimneme, že rozlišení dosahuje nové rovnice, která ukazuje, že energie každé úrovně v atomu závisí na celém čísle, tzv. n, což potvrzuje myšlenku, že energetické hladiny mají specifické hodnoty.
Tedy přiřazení kladných hodnot n (1, 2, 3...), je možné vypočítat energii atomových hladin. Parametr n se nyní nazývá hlavní kvantové číslo, protože je spojeno s každou atomovou úrovní povolenou pro atom.
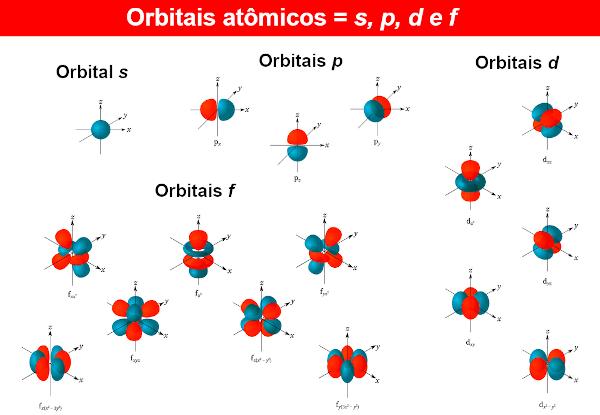
K elektronové vlnové funkce se nazývají atomové orbitaly, jehož matematické výrazy získáme rovněž řešením Schrödingerovy rovnice. Atomový orbital představuje rozložení elektronu v atomu, tedy oblast pravděpodobnosti existence elektronu v atomu. Atomové orbitaly mohou mít různé tvary a energie, také získané Schrödingerovou rovnicí.
Pro každou energetickou hladinu n (Pamatuji si to n může být 1, 2, 3...), existují n podúrovně. V každé podúrovni jsou orbitaly různých tvarů. Neexistuje žádný limit pro různé orbitaly, ale s dosud známými atomy používají chemici pouze čtyři z nich, označené písmeny s, P, d to je F.
Tedy například na úrovni n = 1, existuje pouze jedna podúroveň, takže existuje pouze orbital s. Nyní k úrovni n = 2, existují dvě podúrovně, orbitaly jsou přítomny s to je P.
Pokroky Schrödingerova atomového modelu ve vztahu k jiným atomovým modelům
Jak bylo zmíněno, Schrödinger nepředkládal nutně model, ale matematický výklad. pro pozorované jevy týkající se povahy částic. Proto se její interpretace stává složitou, protože samotná Schrödingerova rovnice potřebuje ke svému řešení a dokonce i k interpretaci pokročilé matematické znalosti.
Nicméně, Schrödingerovy studie přinesly velkou robustnost pro ospravedlnění energie atomů a elektronů dárkové předměty. Například řešení Schrödingerovy rovnice potvrzuje Bohrův atomový model pro atom vodíku a další atomy hydrogenoidu (ty, které mají pouze 1 elektron). Stejně jako Schrödinger i Bohr dospěl k přípustným energetickým úrovním pro atom vodíku.
Bohrův atomový model však není schopen dosáhnout elektronických úrovní pro atomy s více než 1 elektronem, a proto ukazuje jeho hlavní slabinu. Jsou-li přítomny dva elektrony, je nutné uvažovat o elektronickém odpuzování mezi nimi, což je parametr, který lze přidat k matematickému porozumění navrženému Schrödingerem.
Dalším důležitým bodem Schrödingerových studií je přizpůsobení kvantových konceptů, jako je dualita částice, stejně jako přesná trajektorie pro elektron. Definice atomového orbitalu je velmi důležitá pro pochopení struktura všech atomů. A hustota pravděpodobnosti (ψ²) nám pomáhá pochopit, jak elektrony obsazují atomové orbitaly v polyelektronických atomech, přinášející konkrétnější informace o energii elektronu.
Autor: Stefano Araujo Novais
Učitel chemie
Zjistěte více o struktuře atomu a jeho hlavních složkových částicích: protonech, neutronech a elektronech.
Znát vývoj atomového modelu v historii.
Klikněte a dozvíte se o hlavních rysech Rutherfordova atomového modelu a experimentu, který umožnil jeho formulaci.
Zjistěte, jaké jsou hlavní charakteristiky, problémy a z jakých aspektů byl Thomsonův atomový model navržen!
Vstupte a setkejte se s Bohrovým atomem, což byl atomový model založený na postulátech, které úspěšně popsaly atom vodíku.


