THE Zákon rychlosti reakce souvisí rychlost chemické transformace s koncentracemi činidel v množství hmoty (mol / L), které lze uvést následovně:

Zvažte například následující obecnou reakci:
aA + bB → cC + dD
Řekněme, že zvýšíme koncentraci reaktantů A a B, co se stane s rychlostí reakce? Protože množství reaktantních částic ve stejném prostoru vzroste, dojde mezi nimi k účinnějším srážkám, což povede ke zvýšení rychlosti vývoje reakce. Což znamená, že to zvýší vaši rychlost.
Proto je reakční rychlost přímo úměrná koncentraci reaktantů. Záleží to však také na teplotě. Proto máme následující matematickou rovnici, která představuje zákon reakční rychlosti:

O tom, co:
v = rychlost reakce;
k = konstanta, která závisí pouze na hodnotě teploty;
α a β = exponenty určené experimentálně.
Pouze v případě, že reakce je elementární, to znamená, že k ní dojde v jednom kroku, jsou exponenty přesně stejné jako koeficienty vyvážené chemické rovnice: v = k. [THE]The. [B]B. V ostatních případech však musí být příslušná účinnost, na kterou musí být zvýšena koncentrace každého činidla, stanovena experimentálně.
Zákon rychlosti reakce má mnoho jmen, zde je několik: Zákon hromadné akce, rovnice rychlosti, kinetický zákon reakce a zákon Guldberg-Waage.
Zvažte příklad použití tohoto zákona:
Zvažte následující elementární reakci:
2 HCl (G) → H2 (g) + Cl2 (g)
a) Napište rovnici pro rychlost této reakce;
b) Experimenty byly v následující tabulce zaznamenány rychlost této reakce rozkladu plynného chlorovodíku a koncentrace tohoto činidla při konstantní teplotě 25 ° C:
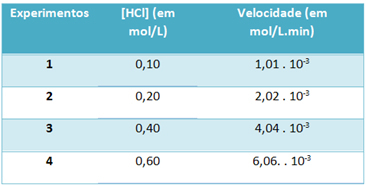
Na základě toho určete charakteristickou rychlostní konstantu této reakce při uvedené teplotě.
Řešení:
The) v = k. [HCl]2
b) v = k. [HCl]2
k = __proti___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
K vyřešení písmene „b“ můžete použít data kteréhokoli z experimentů, že získaná hodnota bude stejná.
Ale co když reakce není elementární? Jak bude možné vyřešit takové otázky v neelementárních reakcích? Chcete-li zjistit jak, přečtěte si zákon rychlosti pro neelementární reakce.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm
