reakce s zásadité oxidy jsou chemické jevy, při kterých je látka této třídy oxidů umístěna ve stejné nádobě jako a anorganická kyselina, a kysličník nebo jeden amfoterní oxid.
Viz také:Reakce s amfoterními oxidy
anorganická sůl a voda jsou běžné produkty v a reakce s bazickými oxidy. Abychom zjistili, zda se bude vyrábět anorganická sůl nebo voda, musíme se podívat na látku, která doprovází bazický oxid v činidle. Podívejte se na příklady níže a pochopte, jak tento proces probíhá.
Reakce s bazickými oxidy a anorganickými kyselinami
Při reakcích mezi bazickými oxidy a anorganickými kyselinami vzniká anorganická sůl a voda, protože bazický oxidový kation (Y+) interaguje s aniontem (X-) kyseliny a hydroniového kationtu (H+) kyseliny interaguje s aniontem oxidu:
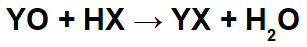
Příklad: Oxid raditý a kyselina bromovodíková
V této reakci máme jako reaktanty oxid radium (RaO) a kyselinu bromovodíkovou (Hbr). Dochází tedy k následujícím interakcím:
Rádiový kation (Ra+2) s bromidovým aniontem (Br-1) tvořící sůl bromidu radia (RaBr2).
Hydroniový kationt (H+1) s oxidovým aniontem (O-2) tvořící vodu (H2Ó).
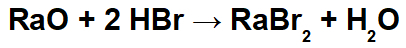
Viz také:Reakce s podvojnými oxidy
Reakce s bazickými oxidy a kyselými oxidy
Při těchto reakcích vzniká anorganická sůl interakcí mezi bazickým oxidovým kationtem (Y+) a výsledný kyselý anion (WOThe-) chemické reakce mezi oxidem kyseliny a vodou.
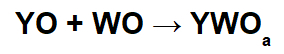
Příklad: Oxid sodný a oxid siřičitý
V této reakci máme oxid sodný (Na2O) a oxid siřičitý (SO2). Je pozoruhodné, že zpočátku, když oxid kyselý interaguje s vodou, dochází k tvorbě kyseliny siřičité (H2POUZE3):
Nepřestávej teď... Po reklamě je toho víc ;)

Od vzniku této kyseliny dochází k interakci mezi sodným kationtem (Na+1) zásaditého oxidu a siřičitanového aniontu (SO3-2) kyseliny, tvořící siřičitan sodný (Na2POUZE3):
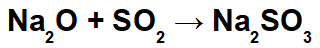
Reakce s bazickými oxidy a amfoterními oxidy
Amfoterní oxidy jsou látky, které vykazují dvojí chemické chování: v přítomnosti kyselé látky se chová jako zásaditý oxid; v přítomnosti látky zásadité povahy se chová jako kysličník.
Takže když a zásaditý oxid reaguje s amfoterním oxidembude se chovat jako kysličník, který v přítomnosti vody vytvoří anorganickou kyselinu. Reakcí mezi aniontem anorganické kyseliny a kationtem zásaditého oxidu vznikne solný produkt.
Příklad: Oxid draselný a oxid chrómu III
V této reakci máme jako reaktanty oxid draselný (K2O) a oxid chromitý (Cr2Ó3). Je pozoruhodné, že zpočátku, když amfoterní oxid interaguje s vodou, dochází k tvorbě chromozomální kyseliny (2HCrO2):

Od vzniku této kyseliny dochází k interakci mezi draselným kationtem (K+1) zásaditého oxidu a chromitového aniontu (SO3-2) kyseliny za vzniku chromitanu draselného (2KCrO2):

Ode mě, Diogo Lopes Dias
Chtěli byste odkazovat na tento text ve školní nebo akademické práci? Koukni se:
DNY, Diogo Lopes. "Reakce se zásaditými oxidy"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm. Zpřístupněno 27. července 2021.
Názvosloví soli, klasifikace soli, název aniontu, název kationtu, síran železnatý, síran železnatý, dusičnany stříbra, chlorid draselný, chlorid sodný, chlorid vápenatý, dusičnan stříbrný, síran měďnatý, uhličitan vápník.