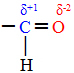Molekuly látek nejsou všechny rovné, jako by byly v jedné rovině. Jsou totiž rozptýleny v prostoru a jejich atomy na sebe berou různá uspořádání či uspořádání. Pro molekuly každého typu látky tedy existují různé geometrické tvary.
Jeden z nejjednodušších způsobů, jak určit geometrii molekuly, je založen na teorii odpuzování valenčních obalových elektronových párů (RPECV). Podle této teorie fungují elektronové páry centrálního atomu jako elektronické mraky které se navzájem odpuzují. Jsou tak orientovány co nejdále od sebe. Molekulární geometrie bude záviset na počtu elektronových párů kolem centrálního atomu.
Tento elektronický mrak může být složen z elektronů, které se podílejí na vazbách (jednoduchých, dvojitých nebo trojných) a také z těch, které se neúčastní. Takže máme:
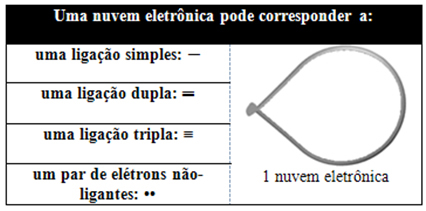
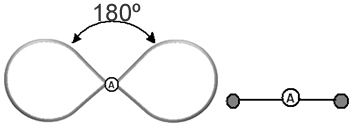
Pomáhá uvažovat o tomto mraku jako o upoutaném balónu nebo balóncích s centrálním atomem v jejich středu. Například v molekule, která má kolem centrálního atomu pouze dva elektronové mraky, tím větší možná vzdálenost mezi nimi je úhel 180º a v důsledku toho bude geometrie molekuly lineární.
Můžeme tedy učinit dedukci o tom, jaká bude molekulární geometrie většiny molekul, pokud vezmeme v úvahu počet atomů v molekulách a vazby, které tvoří centrální atom, kontrola, zda má či nemá páry elektrony.
Podívejte se na příklady níže:
- Molekuly se 2 atomy: vždy budou lineární
Například:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
Nepřestávej teď... Po reklamě je toho víc ;)
- 3-atomová molekula: hranatý nebo trojúhelníkový
pokud centrální atom mají pár nevazebných elektronů geometrie bude hranatýjako v případě molekuly SO2:
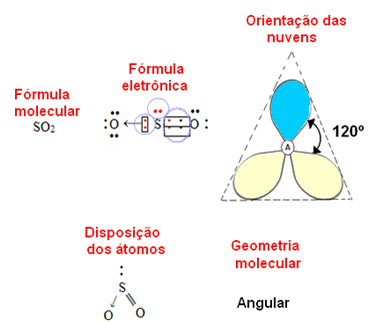
Modrý elektronový mrak považujte za páry elektronů, které se neúčastní vazeb, a žlutý za páry elektronů, které se na vazbách podílejí.
- 4-atomová molekula: rovinný trigonální (nebo trojúhelníkový) nebo pyramidální (nebo trigonální jehlan)
Pokud centrální atom nemá nepárový (nevazebný) elektronový pár, molekulární geometrie je plochá trigonální (nebo trojúhelníková). Podívejte se na příklad BF3:

Pokud má atom nevazebné elektronové páry, geometrie molekuly bude pyramidální (nebo trigonální pyramida), jako v případě amoniaku:

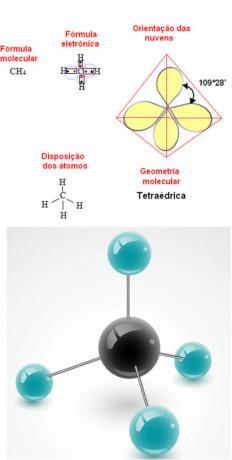
- 5-atomová molekula: čtyřstěnný
Příklad metanové geometrie:
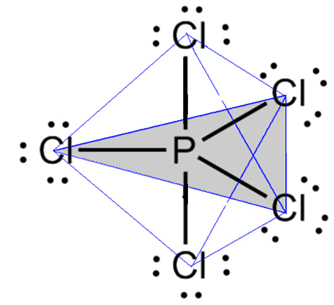
- Molekula se 6 atomy: trigonální bipyramida nebo trojúhelníková pyramida.
Příkladem je chlorid fosforečný (PCl5), který má některá spojení mezi fosforem a chlórem pod úhlem 90º a jinými 120º, tvořící bipyramidu s trojúhelníkovou základnou:
- 7-atomová molekula: osmistěnný
Příklad: fluorid sírový (SF6), jehož úhly jsou 90º.

Autor: Jennifer Fogaça
Vystudoval chemii
Chtěli byste odkazovat na tento text ve školní nebo akademické práci? Koukni se:
FOGAÇA, Jennifer Rocha Vargas. "Určení geometrie molekul"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. Zpřístupněno 27. července 2021.