THE těstovinyatomový, jak jeho název napovídá, je to hmotnost atomu, obvykle symbolizovaná „mThe“ nebo „MA“. Jelikož je však atom extrémně malá entita, pro lidské oči neviditelná, není možné změřit jeho hmotnost například pomocí vah. Vědci tedy určili hmotnost atomů jejich porovnáním s hmotnostmi jiných atomů.
To se provádí i s ostatními jednotkami. Jednotkou hmotnosti je například standardní kilogram, což odpovídá válci o výšce a průměru 3,917 cm, vyrobenému z 10 % iridia a 90 % platiny. Slouží tedy jako srovnání. Pokud například „zvážíme“ předmět na váze a zjistíme, že jeho hmotnost je 10 kg, znamená to, že jeho hmotnost je 10krát větší než zvolený standard: 1 kg.
Totéž platí pro atomy. Jako standard byl zvolen uhlík-12 a tomuto atomu byla libovolně přiřazena hmotnost 12 u. „u“ je jednotka atomové hmotnosti, a proto je ekvivalentní 1/12 hmotnosti atomu uhlíku.
Když například řekneme, že atomová hmotnost vodíku je rovna 1 u, znamená to, že je to jakoby pokud uhlík rozdělíme na 12 částí, hmotnost jedné z těchto částí je ekvivalentní hmotnosti atomu vodík. Dalším příkladem je síra, její atomová hmotnost je 32 u, což znamená, že její hmotnost je 32krát větší než 1/12 hmotnosti
12C.1 u = 1/12 hmotnosti 1 atomu uhlíku 12

Atomová hmotnostní jednotka je 1/12 hmotnosti uhlíku-12
Molekulová hmotnost látek je součtem atomových hmotností prvků. Například atomová hmotnost kyslíku je rovna 16 u, takže molekulová hmotnost molekuly plynného kyslíku (O2) se rovná 32u.
Protože laboratorní techniky jsou v současné době velmi pokročilé, existují zařízení, která přesně měří atomovou hmotnost prvků, jako je hmotnostní spektrometr. Je tedy možné to poznat 1 u se rovná 1,66054. 10-24 G.
Mind Map: Atomic Mass

*Pro stažení myšlenkové mapy v PDF, Klikněte zde!
Protože atomové hmotnosti jsou určeny s velkou přesností, jsou uvedeny v periodické tabulce ve formě desetinných čísel. Ale když jdeme dělat výpočty, obvykle používáme zaokrouhlené číslo, s výjimkou experimentů, které musí být velmi přesné. Když se například podíváte na periodickou tabulku, uvidíte, že atomová hmotnost kyslíku se rovná 15 999 u, ale obecně ve výpočtech používáme hodnotu 16 u. To se děje také s uhlíkem, jehož atomová hmotnost je dána 12,01 u, jak je uvedeno níže:
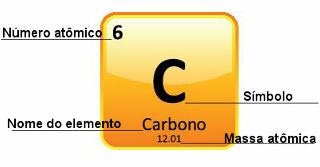
Zastoupení uhlíku v periodické tabulce
Prvky, které se objevují v periodické tabulce, jsou ve skutečnosti váženým průměrem všech přirozených izotopů prvku. Atomová hmotnost uvedená v tabulce je tedy také průměrem atomových hmotností těchto prvků. Například chlor (C2) má dva přírodní izotopy, 35 a 37, jejichž příslušná procenta v přírodě jsou 75,76 % a 24,24 %. Atomové hmotnosti každého z těchto izotopů jsou různé, přičemž atomová hmotnost Cy-35 je 34,96885 u a atomová hmotnost Cy-37 je 36,96590.
Tímto způsobem se vypočítá atomová hmotnost prvku s přihlédnutím k hmotnosti každého izotopu a množství, s nímž se vyskytuje v přírodě. V případě chlóru máme:
Atomová hmotnost prvku chlor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atomová hmotnost prvku chlor = 35,45
Toto je hodnota atomové hmotnosti chloru, která se objevuje v periodické tabulce.
* Myšlenková mapa od Me. Diogo Lopes
Autor: Jennifer Fogaça
Vystudoval literaturu
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm

