Kp je zkratka používaná k určení konstanta rovnováhy z hlediska parciálních tlaků. Tato konstanta pracuje například s hodnotami plynných účastníků rovnováhy v jednotce atm.

Rovnice představující chemickou reakci s plynnými složkami
V této rovnici jsou všichni účastníci plynní, takže když má zúčastněný plyn a parciální tlak ve směsi, je reprezentován zkratkou pX.
Při sestavování rovnice chemické rovnováhy (z hlediska koncentrace) je třeba produkty umístit do čitatele a reaktanty do jmenovatele:
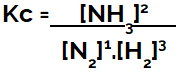
Kc vyjádření rovnováhy tvorby amoniaku
výraz rovnovážná konstanta z hlediska tlaku (Kp) následuje po vzoru Kč, to znamená, že parciální tlaky činidel jsou umístěny ve jmenovateli a parciální tlaky produktů v čitateli:
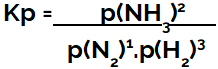
Kp vyjádření rovnováhy tvorby amoniaku
Pozorování: Pokud je reakční rovnice chemická bilance nepředstavují žádného plynného účastníka, nebude se automaticky prezentovat Kp.
Příklad: (PUC-MG) Pro reakci: 2 CO(G) + O2(g)? 2 CO2(g), parciální tlaky CO(G) to je2(g) v rovnováze jsou 0,2 atm a 0,4 atm. Celkový tlak v systému je 1,4 atm. Hodnota Kp protože reakce je:
a) 56,2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
Údaje poskytnuté cvičením jsou:
Parciální tlak oxidu uhelnatého (pCO) = 0,2 atm;
Parciální tlak oxidu uhelnatého (pO2) = 0,4 atm;
Celkový tlak = 1,4 atm;
Abychom určili Kp tohoto systému, musíme provést následující kroky:
1. krok: Určete parciální tlak oxidu uhelnatého (pCO2).
Za tímto účelem si pamatujte, že celkový tlak (pt) je součtem všech parciálních tlaků:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. krok: Určete Kp cvičení.
K tomu stačí použít hodnoty ve vyjádření rovnovážné konstanty Kp:
Kp = (pCO2)2
(pCO)2.(prach2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Ode mě, Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
