Distribuce elektronů nebo konfigurace elektronů způsob, jakým jsou uspořádány chemické prvky, s ohledem na počet elektronů, které mají, a jejich blízkost k atomovému jádru.
Elektronická odstupňovaná distribuce
Poté, co se objevilo několik atomových modelů, Bohrův model navrhl uspořádání elektrosféry na oběžné dráhy.
Elektrony jsou organizovány a distribuovány elektronickými vrstvami, některé jsou blíže k jádru a jiné dále.
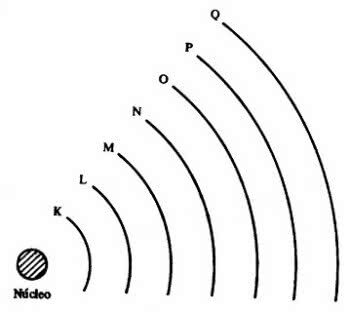
Poté přišlo 7 elektronických vrstev (K, L, M, N, O, P a Q), které jsou v periodické tabulce reprezentovány vodorovnými liniemi číslovanými od 1 do 7.
Prvky na stejných řádcích mají stejný maximální počet elektronů a také stejné energetické úrovně.
Je tedy možné pozorovat, že elektrony jsou v energetických úrovních a podúrovních. Každý z nich má tedy určité množství energie.
|
Úroveň energie |
Elektronická vrstva |
Maximální počet elektronů |
|---|---|---|
| 1° | K. | 2 |
| 2° | L | 8 |
| 3° | M | 18 |
| 4° | N | 32 |
| 5° | Ó | 32 |
| 6° | P | 18 |
| 7° | Q | 8 |
THE valenční vrstva je to poslední elektronická vrstva, tj. nejvzdálenější vrstva atomu. Podle
Pravidlo oktetu, atomy mají tendenci se stabilizovat a stát se neutrálními.To se stane, když mají stejné množství protonů a neutronů s osmi elektrony v posledním elektronovém obalu.
Později se objevily energetické úrovně, představované malými písmeny s, p, d, f. Každá podúroveň podporuje maximální počet elektronů:
| podúrovně | Maximální počet elektronů |
|---|---|
| s | 2 |
| P | 6 |
| d | 10 |
| F | 14 |
Paulingův diagram
Americký chemik Linus Carl Pauling (1901-1994) studoval atomové struktury a vytvořil schéma, které se používá dodnes.
Pauling našel způsob, jak dát všechny energetické úrovně do vzestupného pořadí pomocí úhlopříčného směru. Tento režim se stal známým jako Paulingův diagram.
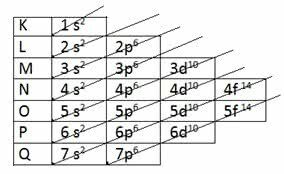
Vzestupně: 1 s2 2 s2 2 s6 3 s2 3p6 4 s2 3d10 4p6 5 s2 4d10 5p6 6 s2 4f14 5 d10 6p6 7 s2 5f14 6d10 7p6
Všimněte si, že číslo uvedené před podúrovní energie odpovídá energetické úrovni.
Například za 1 s2:
- s označuje energetickou podúroveň
- 1 označuje první úroveň umístěnou na vrstvě K.
- exponent 2 označuje počet elektronů v této podúrovni
Jak provést elektronickou distribuci?
Chcete-li lépe porozumět procesu elektronické distribuce, podívejte se na níže uvedené vyřešené cvičení.
1. Proveďte elektronickou distribuci prvku Železo (Fe), který má atomové číslo 26 (Z = 26):
Při použití diagramu Linus Pauling se úhlopříčky procházejí ve směru uvedeném v modelu. Energetické podúrovně jsou naplněny maximálním počtem elektronů na elektronový obal, dokud nedokončí 26 elektronů prvku.
Chcete-li provést distribuci, věnujte pozornost celkovému počtu elektronů v každé podúrovni a v příslušných elektronických vrstvách:
K - s2
L - 2 s2 2 s6
M - 3 s2 3p6 3d10
N - 4 s2
Všimněte si, že nebylo nutné provádět elektronickou distribuci ve všech vrstvách, protože atomové číslo železa je 26.
Elektronická distribuce tohoto prvku je tedy znázorněna následovně: 1s2 2 s2 2 s6 3 s2 3p6 4 s2 3d6. Součet čísel exponentů činí celkem 26, tj. Celkový počet elektronů přítomných v atomu železa.
Pokud je elektronická distribuce označena vrstvami, je znázorněna takto: K = 2; L = 8; M = 14; N = 2.
Využijte příležitosti a otestujte si své znalosti v Cvičení z elektronické distribuce.
Na periodická tabulka, je to zobrazeno následovně:

Přečtěte si také:
- Elektronická afinita
- Kvantová čísla
- Cvičení na periodické tabulce
- Cvičení z organizace periodické tabulky