Transformace, ke kterým dochází v materiálech, jsou klasifikovány jako chemické a fyzikální.
Fyzické transformace, i když jsou vnímatelné změnou vzhledu materiálu, probíhají prchavěji a nemění podstatu látky.
Chemické transformace jsou na druhé straně tak intenzivní, že mění složení materiálu a způsobují, že transformace produkuje chemicky odlišnou látku, než jakou měla na začátku.
Fyzická transformace se liší od chemické transformace, protože: v nové chemické transformaci látky se tvoří, zatímco fyzickou přeměnou se mění forma materiálu, ale jeho složení je stejné.
Fyzické transformace
Když změníme velikost nebo tvar materiálu, dojde ke změně, ale nelze ji změnit na jinou.
Podíváme-li se mikroskopicky, vidíme, že atomy, ionty nebo molekuly procházejí mícháním nebo přeskupením, ale nejsou změněny.
Vidíme to na změny fyzického stavu.

Všimněte si, že:
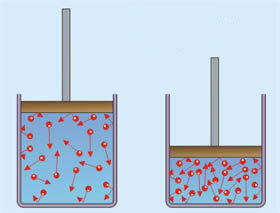
- Pevný: částice zůstávají ve stálých polohách, takže objem a tvar jsou dobře definované.
- Kapalný: částice se pohybují volněji, a proto má kapalina specifický objem, ale její tvar se liší podle nádoby.
- Plynný: částice se pohybují všemi směry a velkou rychlostí a zaplňují celou nádobu, takže objem a tvar jsou proměnlivé.
Nejběžnějším příkladem fyzických transformací je fyzikální stavy vody.

Když ohříváme vodu, odpařuje se, pokud vodu zmrazíme, ztuhne, a když ji necháme ohřát na pokojovou teplotu, vrátí se do kapalného stavu.
Voda v různých stavech má své molekuly přeuspořádané, ale její složení je stejné. Takže máme fyzickou transformaci.
chemické transformace
Nové látky vznikají, když hmota prochází chemickou transformací. Z reagencií se vyrábějí reakce.
Reakce způsobují rozbití nebo tvorbu chemických vazeb, ale atomy, které se účastní reakce, jsou stejné, pouze přeskupené.
Zaznamenali jsme výskyt chemické transformace v důsledku vzhledu světla, vzhledu plynových bublin, tvorby pevných částic, změny barvy a vnímání vůně.
Podívejme se na tento příklad:

Sodík je alkalický kov a jako charakteristika této rodiny reaguje prudce s vodou.
Reakce mezi sodíkem a vodou generuje hydroxid kovu a uvolňuje plynný vodík.
Míchání nebo chemická transformace?
Když smícháme dvě látky, transformace nemusí vždy nastat.
Například když smícháme železo a síru, získáme jinou barevnou směs látek, pokud je pozorujeme zvlášť.
Použitím magnetu jsme byli schopni přilákat železo a oddělit ho od síry magnetismus. To znamená, že je smícháme dva, ale neztratili své původní vlastnosti.

Pokud však smícháme železo a síru v definovaném poměru 7 g, respektive 4 g, a dáme to zahřát, vznikne černě zbarvená látka, je to sirník železitý II.
Tímto způsobem již nelze železo oddělit, protože se přeměnilo na jinou látku.
Došli jsme k závěru, že: směs je fyzikální jev, zatímco reakce je chemický jev.
Fyzikální a chemické jevy
Transformace, které hmota trpí, když prochází nějakou změnou, se také nazývá fyzikální a chemické jevy.
Podívejme se na tyto dva příklady:
voda a cukr
Cukr je kovalentní sloučenina a po rozpuštění ve vodě se molekuly rozptýlí, ale nezmění jejich identitu. Je to fyzikální jev.

Voda a sůl
Když dáme sůl do vody, ionty disociují, jak ukazuje chemická rovnice:
Jelikož se jedná o iontovou a ve vodě rozpustnou sloučeninu, prochází chlorid sodný změnou a rozpadá se na své ionty. Je to chemický jev.

Kationty a anionty jsou solvatovány, když záporný pól vody zahrnuje ionty sodíku (kationty) a kladný pól vody chloridové ionty (anionty).
Příroda i lidé jsou schopni transformovat materiály. Přirozeně, ovoce hnije a rezavě železo. Ale také provokujeme transformace, když vaříme vodu nebo pečeme maso. Toto jsou příklady hmotných jevů, kterých jsme svědky v každodenním životě.
Podívejte se také: Fyzikální a chemické jevy
Kvíz - Fyzikální a chemické transformace
Nyní, když víte, jak rozlišovat fyzikální a chemické transformace, otestujte své znalosti v následujícím kvízu:
Využijte následující cvičení a otestujte své znalosti:
- Cvičení z vlastností hmoty
- Cvičení k oddělování směsí
- Cvičení na homogenní a heterogenní směsi