Periodické vlastnosti chemických prvků jsou vlastnosti, které mají.
Všimněte si, že chemické prvky v periodické tabulce mají specifické umístění, které se mění podle periodických vlastností, které vykazují. Jsou řazeny vzestupně podle atomového čísla.
Podle Moseleyho zákona:
“Mnoho fyzikálních a chemických vlastností prvků se pravidelně mění v pořadí atomových čísel prvků..”
Hlavní periodické vlastnosti
atomový poloměr
Vztahující se k velikosti atomů je tato vlastnost definována vzdáleností mezi středy jader dvou atomů stejného prvku.
Proto atomový paprsek odpovídá polovině vzdálenosti mezi jádry dvou sousedních atomů, vyjádřeno takto:
r = d / 2
Kde:
r: Blesk
d: mezijaderná vzdálenost
Měří se v pikometry (odpoledne). Toto měření je podmnožinou měřiče:
13:00 = 10-12 m
V periodické tabulce se atomový poloměr zvyšuje ve svislé poloze shora dolů. Na horizontále se zvětšují zprava doleva.
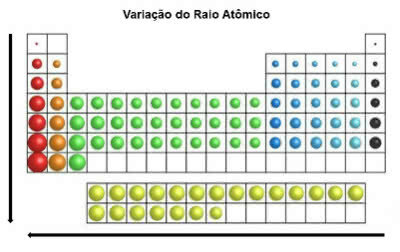
Variace atomového poloměru
Chemický prvek, který má největší poloměr atomu, je cesium (Cs).
Atomový objem
Tato periodická vlastnost označuje objem obsazený 1 mol prvku v pevném stavu.
Stojí za zmínku, že atomový objem není objemem 1 atomu, ale sadou 6,02. 1023 atomy (hodnota 1 mol)
Atomový objem atomu je definován nejen objemem každého atomu, ale také mezerou, která existuje mezi těmito atomy.
V periodické tabulce se hodnoty atomového objemu zvyšují shora dolů (svisle) a od středu k okraji (vodorovně).

Variace atomového objemu
Pro výpočet atomového objemu se používá následující vzorec:
V = m / d
Kde:
PROTI: atomový objem
m: hmotnost 6,02. 1023 atomy prvků
d: hustota prvků v pevné fázi
Absolutní hustota
THE hustota absolutní, také nazývaná „specifická hmotnost“, je periodická vlastnost, která určuje vztah mezi hmotou (m) látky a objemem (v) obsazeným touto hmotou.
Vypočítává se podle následujícího vzorce:
d = m / v
Kde:
d: hustota
m: těstoviny
proti: objem
V periodické tabulce se hodnoty hustoty zvyšují shora dolů (svisle) a od okrajů ke středu (vodorovně).
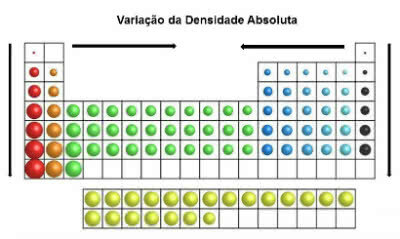
Variace absolutní hustoty
Nejhustší prvky jsou tedy ve středu a ve spodní části tabulky:
Osmium (Os): d = 22,5 g / cm3
Iridium (Ir): d = 22,4 g / cm3
Bod tání a bod varu
Další důležitá periodická vlastnost souvisí s teplotami, do kterých prvky vstupují tání a vaření.
Bod tání (MP) je teplota, při které hmota přechází z pevné do kapalné fáze. Bod varu (PE) je teplota, při které hmota přechází z kapaliny do plynné fáze.
V periodické tabulce se hodnoty PF a PE liší podle toho, které strany jsou v tabulce umístěny.
Svisle a na levé straně stolu se zvyšují zdola nahoru. Na pravé straně se zvětšují shora dolů. Ve vodorovném směru se táhnou od konců ke středu.

Variace bodu tání a varu
Elektronická afinita
Také se nazývá „elektroafinita“, jedná se o minimální energii požadovanou chemickým prvkem k odstranění elektronu z aniontu.
Toto je elektronická afinita označuje množství energie uvolněné, když je elektron přijat atomem.
Všimněte si, že tento nestabilní atom je sám a v plynném stavu. S touto vlastností získává stabilitu, když přijímá elektron.
Na rozdíl od atomového poloměru roste elektroafinita prvků v periodické tabulce zleva doprava, horizontálně. Ve svislém směru se zvyšuje zdola nahoru.
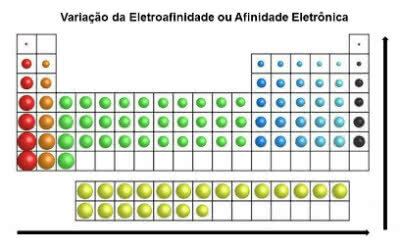
Varianta elektronické afinity
Chemický prvek, který má největší afinitu k elektronům, je chlor (Cl), s hodnotou 349 KJ / mol.
Ionizační energie
Také zvaný "ionizační potenciál”, Tato vlastnost je v rozporu s vlastností elektronické afinity.
Jedná se o minimální energii požadovanou chemickým prvkem k odstranění elektronu z neutrálního atomu.
Tato periodická vlastnost tedy ukazuje, kolik energie je potřeba k přenosu elektronu z atomu v základním stavu.
Takzvaný „základní stav atomu“ znamená, že jeho počet protonů se rovná jeho počtu elektronů (str+ = a-).
Po odstranění elektronu z atomu je tedy ionizován. To znamená, že získává více protonů než elektrony, a proto se stává kationtem.
V periodické tabulce je ionizační energie v rozporu s energií atomového poloměru. Zvyšuje se tedy zleva doprava a zdola nahoru.
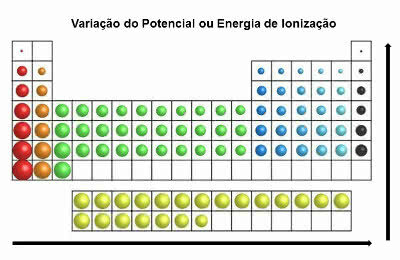
Varianta ionizační energie
Prvky, které mají největší ionizační potenciál, jsou fluor (F) a chlor (Cl).
elektronegativita
Vlastnost atomů prvků, které mají tendenci přijímat elektrony v chemické vazbě.
Vyskytuje se v kovalentních vazbách v době sdílení elektronových párů. Při přijímání elektronů jsou atomy ponechány se záporným nábojem (aniontem).
Pamatujte, že je to považováno za nejdůležitější vlastnost periodické tabulky. Je to proto, že elektronegativita indukuje chování atomů, ze kterých se tvoří molekuly.
V periodické tabulce je elektronegativita zvětšuje se zleva doprava (vodorovně) a zdola nahoru (svisle)
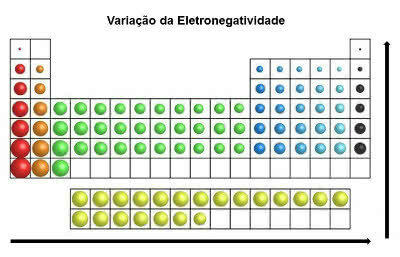
Varianta elektronegativity
Nejelektronegativnějším prvkem periodické tabulky je tedy fluor (F). Na druhé straně jsou cesium (cs) a francium (fr) nejméně elektronegativními prvky.
elektropozitivita
Na rozdíl od elektronegativity tato vlastnost elementárních atomů naznačuje tendence ke ztrátě (nebo vzdání se) elektronů v chemické vazbě.
Při ztrátě elektronů získají atomy prvků kladný náboj, čímž vytvoří kation.
Ve stejném směru jako atomový poloměr a na rozdíl od elektronegativity, v periodické tabulce a elektropozitivita zvyšuje zprava doleva (vodorovně) a shora dolů (svisle).
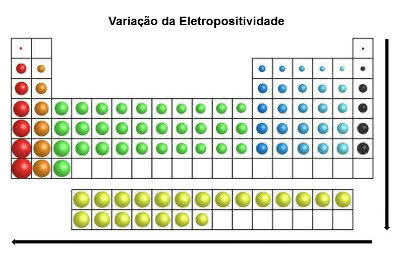
Variace elektropositivity
Chemické prvky s nejvyšší elektropozitivitou jsou kovy, a proto se této vlastnosti říká také „kovový charakter“. Nejelektropozitivnějším prvkem je Francium (Fr) s maximální tendencí k oxidaci.
Pozornost!
Vy "vzácné plyny„Jsou inertní prvky, protože neprovádějí chemické vazby a stěží darují nebo přijímají elektrony. Rovněž mají potíže s reakcí s jinými prvky.
Elektronegativita a elektropozitivita těchto prvků proto nejsou brány v úvahu.
Přečtěte si také:
- Chemické vazby
- Historie periodické tabulky
- Rodiny s periodickými tabulkami
Aperiodické vlastnosti
Kromě periodických vlastností máme i neperiodické vlastnosti. V tomto případě se hodnoty zvyšují nebo snižují s atomovým počtem prvků.
Dostávají toto jméno, protože neposlouchají svou pozici v periodické tabulce jako periodické tabulky. To znamená, že se neopakují v pravidelných intervalech.
Hlavní neperiodické vlastnosti jsou:
- Atomová hmotnost: Tato vlastnost se zvyšuje s rostoucím atomovým číslem.
- Specifické teplo: tato vlastnost klesá s rostoucím atomovým číslem. Pamatujte, že specifické teplo je množství tepla potřebné ke zvýšení teploty o 1 ° C o 1 g prvku.
Cvičení na přijímací zkoušky se zpětnou vazbou
1. (PUC-RJ) Zvažte výroky o prvcích skupiny IA v periodické tabulce
I. Říká se jim alkalické kovy.
II. Jeho atomové paprsky rostou s atomovým číslem.
III. Jeho ionizační potenciál se zvyšuje s atomovým číslem.
IV: Jeho kovový charakter se zvyšuje s atomovým číslem.
Mezi tvrzeními platí:
a) I a II
b) III a IV
c) I, II a IV
d) II, III a IV
e) I, II, III a IV
Alternativní c
2. (UFMG) Ve srovnání chloru a sodíku, dvou chemických prvků, které tvoří kuchyňskou sůl, můžete říci, že chlor:
a) je hustší.
b) je méně volatilní.
c) má větší kovový charakter.
d) má nižší ionizační energii.
e) má menší atomový poloměr.
Alternativní a
3. (UFC-CE) Fotoelektrický efekt se skládá z emise elektronů z kovových povrchů prostřednictvím dopadu světla příslušné frekvence. Tento jev je přímo ovlivněn ionizačním potenciálem kovů, který byl do značné míry ovlivněn používané při výrobě fotoelektronických zařízení, jako jsou: fotobuňky veřejného osvětlení, fotoaparáty fotografické atd. Na základě variací ionizačního potenciálu prvků v periodické tabulce označte alternativu, která obsahuje kov, který nejpravděpodobněji vykazuje fotoelektrický efekt.
a) Fe
b) Hg
c) Čs
d) Mg
e) Ca
Alternativní c
Zkontrolujte otázky přijímací zkoušky s komentovaným rozlišením v Cvičení na periodické tabulce a nepublikované otázky na toto téma v Cvičení z organizace periodické tabulky.
Přečtěte si také:
- Periodická tabulka
- Elektronická distribuce
- Chemické prvky
- Mezimolekulární síly