Hybridizace uhlíku typu sp2 nastává, když má dvojnou vazbu a dvě jednoduché vazby nebo vazbu pi (π) a tři vazby sigma (σ). Ve skutečnosti sp hybridizace2 vzniká mezi atomy, které vytvářejí dvojnou vazbu.
Příkladem takové molekuly je formaldehyd (CH2Ó). Všimněte si jeho struktury níže:
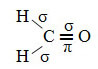
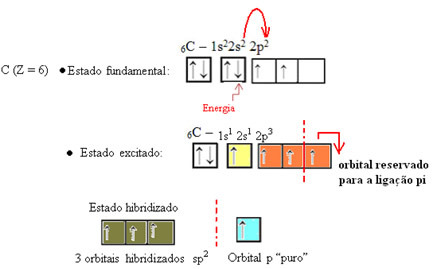
Jak je vidět v textu "hybridizace typu sp3”, Hybridizace uhlíku nastává, když elektron z podúrovně 2s přijímá energii a je„ transportován “do 2p podúrovně, a tak vznikají 4 hybridizované orbitaly ze „směsi“ atomových orbitalů čistý.
V případě formaldehydu víme, že bude existovat vazba pí, takže jeden z těchto hybridizovaných orbitalů je vyhrazen pro tuto vazbu, zatímco ostatní tři nesou vazby sigma:
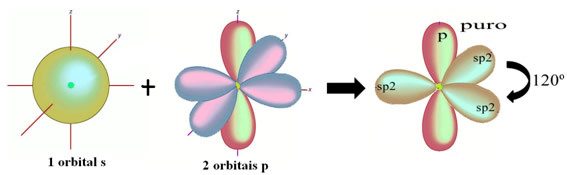
Atomy vodíku, které tvoří jednoduchou vazbu s uhlíkem, vytvářejí svou orbitál:
Zbývající „čistá“ orbitální dvojná vazba atomu kyslíku a molekuly formaldehydu má následující strukturu:
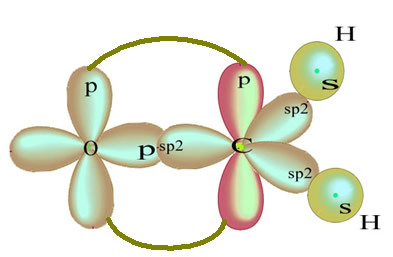
Pokud jde o typ vazeb existujících v této struktuře formaldehydu, máme:

Připojení: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm

