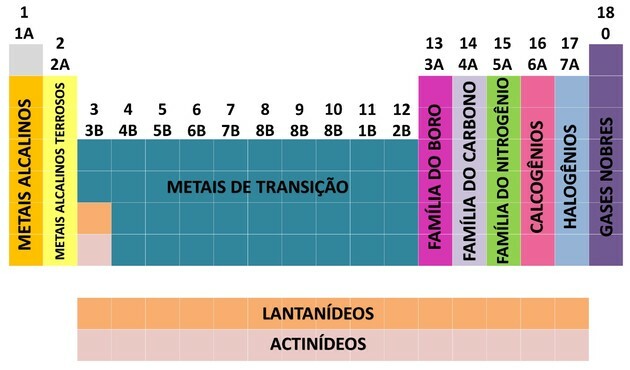
Jedním ze způsobů, jak jsou chemické prvky organizovány, jsou rodiny, které odpovídají svislým sekvencím periodické tabulky.
Na 18 sloupců tabulky seskupit prvky podle podobností chemických vlastností.
Organizace chemických prvků do rodin byla praktickým způsobem, jak strukturovat různé nalezené informace a prezentovat je jednoduchým způsobem.
Pro usnadnění umístění chemického prvku byly rodiny označeny v číslech od 1 do 18 takto:
Díky příspěvku mnoha vědců a různým pokusům o uspořádání dat se vyvinula periodická tabulka, která stanovila pořadí pro uspořádání prvků.
Názvosloví rodin
- Rodiny v tabulce byly rozděleny na A (reprezentativní) a B (přechod), které byly identifikovány písmeny a čísly.
- Vy reprezentativní prvky rodiny 0, 1A, 2A, 3A, 4A, 5A, 6A a 7A odpovídají.
- Vy přechodové prvky rodiny 1B, 2B, 3B, 4B, 5B, 6B, 7B a 8B odpovídají.
- Stanovením Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC) byly rodiny identifikovány v skupiny od 1 do 18.
Periodická tabulka a elektronická distribuce
K podobnostem mezi prvky stejné rodiny dochází, protože počet valenčních elektronů atomu v základním stavu je stejný pro členy určité skupiny.
Například:
| Skupina 1 | Elektronická distribuce |
|---|---|
| 3číst | 2-1 |
| 11Na | 2-8-1 |
| 19K. | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Čs | 2-8-18-18-8-1 |
| 87Fr. | 2-8-18-32-18-8-1 |
Atomy skupiny 1 mají své elektrony rozložené na více než jedné energetické úrovni, ale všechny mají valenční elektron.
S tím pozorujeme, že výroba elektronická distribuce atomu v základním stavu najdeme jeho polohu na periodické tabulce.
reprezentativní prvky
Reprezentativní prvky vykazují relativně méně složité chemické chování než přechodné prvky a tvoří většinu látek kolem nás.
Některé z reprezentativních rodin elementů dostávají speciální jména, jak je uvedeno níže:
Skupina |
Rodina | konkrétní název | Původ jména | Elementy | elektronická konfigurace |
|---|---|---|---|---|---|
| 1 | 1A | alkalické kovy | z latiny alkálie, což znamená „šedá rostlina“. | Li, Na, K, Rb, Cs a Fr | nás1 |
| 2 | 2A | kovy alkalických zemin | Termín „pozemský“ označuje „existující na Zemi“. | Buďte, Mg, Ca, Sr, Ba a Ra | nás2 |
| 13 | 3A | rodina boru | Název prvního prvku rodiny. | B, Al, Ga, In, Tl a Nh. | nás2np1 |
| 14 | 4A | uhlíková rodina | Název prvního prvku rodiny. | C, Si, Ge, Sn, Pb a Fl. | nás2np2 |
| 15 | 5A | Rodina dusíku | Název prvního prvku rodiny. | N, P, As, Sb, Bi a Mc. | nás2np3 |
| 16 | 6A | Chalkogeny | z řečtiny khalks, protože jsou to prvky nacházející se v měděných rudách. | O, S, Se, Te, Po a Lv. | nás2np4 |
| 17 | 7A | Halogeny | Řecký výraz znamenající formovače soli. | F, Cl, Br, I, At a Ts. | nás2np5 |
| 18 | 0 | Vzácné plyny | Předpokládalo se, že nereaguje s jinými látkami. | On, Ne, Ar, Kr, Xe, Re a Og. | 1 s2 (On) nebo my2np6 |
Z tabulky vidíme, že:
- Výše uvedené prvky jsou klasifikovány jako reprezentativní, protože mají nejvíce energetický elektron v podúrovni s nebo p.
- Elektrony jsou distribuovány na energetických úrovních a n představuje nejvzdálenější hladinu atomu v základním stavu.
- Reprezentativní prvky podle doporučení IUPAC patří do skupin nebo rodin 1,2,13,14,15,16,17 a 18.
Ó vodík je klasifikován odděleně od ostatních prvků. I s elektronickou konfigurací 1 s1, není součástí skupiny 1 pro prezentaci jedinečného chování.
přechodové prvky
Přechodové prvky odpovídají skupinám 3 až 12. Dostávají toto jméno, protože mají střední charakteristiky mezi skupinami 1 a 2 a reprezentativními nekovovými prvky.
Vy přechodné kovy jsou definovány IUPAC jako:
Přechodový prvek má neúplnou podúroveň d nebo může tvořit kationty s neúplnou podúrovní d.
Když je nejenergetičtější elektron atomu základního stavu v neúplné d podúrovni, je charakterizován jako vnější přechod.
Lanthanidy a aktinidy jsou vnitřní přechodové prvky, protože mají alespoň jednu neúplnou f podúrovni.
Pokud prvky mají elektrony, které vyplňují orbitaly d nebo f, vykazují podobné vlastnosti a lze je rozdělit na orbitální prvky d nebo f. vnější nebo vnitřní přechod.
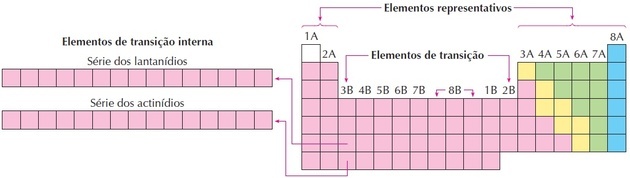
Jak vidíme na obrázku, rodina 8B odpovídá 3 sloupcům, jedná se o skupiny 8, 9 a 10, které byly takto seskupeny, protože mají podobné vlastnosti.
Hlavní charakteristiky rodin
Níže uvedená tabulka ukazuje hlavní vlastnosti skupin v periodické tabulce:
| Skupina | Funkce | složené látky častější |
výskyty |
|---|---|---|---|
| 1 | Pevné a lesklé v okolních podmínkách. Velmi reaktivní, měkké a dobré vodiče elektřiny. | Soli, hydroxidy a oxidy |
Reagujte s halogeny a vytvořte soli. |
| 2 | Méně reaktivní a tvrdší než skupina 1. Pevné látky stříbra s dobrou vodivostí. | Soli, hydroxidy a oxidy |
Tvořící soli a oxidy. |
| 3 až 12 | Tvoří komplexy. Jsou to kovové pevné látky, tvrdé a křehké, s výjimkou rtuti, která je kapalinou. | Soli, oxidy a komplexy. Příklad: AgNO3, TiO a [Cr (OH)3(H2Ó)3] |
V minerálech ve formě oxidů. |
| 13 | Pevné látky v okolních podmínkách, stříbro, s výjimkou boru. | Oxidy Příklad: B2Ó3 |
V minerálech ve formě oxidů. |
| 14 | Pevný za okolních podmínek. | Atomy C a Si se mohou uspořádat do řetězců a produkovat obrovské množství látek. | V živých organismech a ve formě křemičitanů nebo oxidů. |
| 15 | Pevné látky, s výjimkou dusíku, který je za okolních podmínek plynný. | Oxidy a kyseliny Příklad: NE2 a H3PRACH4 |
Atmosféra, živé organismy a minerály. |
| 16 | Pevné látky, s výjimkou kyslíku, který je za okolních podmínek plynný. | Sulfidy a oxidy Příklad: ZnS a SiO2 |
Atmosféra, živé organismy a minerály. |
| 17 | Tvoří diatomické molekuly a jsou velmi reaktivní. Jsou špatnými vodiči elektřiny a tepla. Jsou agresivní vůči živým bytostem a životnímu prostředí. | Kyseliny a soli. Příklad: HCl a KBr |
Jsou přítomny v látkách organické a minerální. |
| 18 | Jsou velmi stabilní a nacházejí se ve formě plynů. | Sotva tvoří složené látky. | Plyny v atmosféře. |
Chemické a fyzikální vlastnosti odlišují jednu rodinu od druhé. Jak jsme viděli, chemické vlastnosti souvisí s elektrony valence, a prostřednictvím nich atom interaguje s jiným, je zodpovědný za chemické chování a chemické vazby vytvořen.
Fyzikální vlastnosti prvků ve stejné skupině se mohou lišit podle atomového čísla a hmotnosti.
Cvičení
Nyní, když víte něco víc o rodinách periodických tabulek, otestujte své znalosti a podívejte se, co jste se naučili.
1) Zvažte následující výňatek z Periodické tabulky.
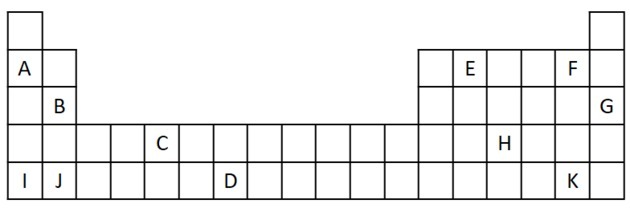
a) Pojmenujte dva prvky, které mají dva valenční elektrony.
b) Uveďte prvek, který prudce reaguje s vodou za vzniku hydroxidu kovu.
c) Uveďte nereaktivní prvek.
d) Uveďte dva prvky, které se spojí s alkalickými kovy za vzniku solí.
Odpověď:
a) B a J
Dva valenční elektrony odpovídají skupině 2, která má elektronovou konfiguraci ns2 a jsou v cvičení zastoupeni B a J.
b) A, B, I nebo J.
A a I představují prvky rodiny 1; B a J jsou z rodiny 2. Jak jsme viděli v tabulce vlastností, prvky skupiny 1 a 2 jsou velmi reaktivní a mohou tvořit hydroxidy, jako v uvedených příkladech: KOH a Mg (OH)2.
c) G
Ušlechtilé plyny jsou velmi stabilní, a proto nejsou příliš reaktivní. Písmeno G je vloženo do tabulky jako prvek této rodiny.
d) F a K.
Halogeny reagují s alkalickými kovy za vzniku solí. Nejběžnějším příkladem je kuchyňská sůl, NaCl.
2) Následující obrázek ukazuje tři chemické prvky, zleva doprava, lithium, sodík a draslík.

Vyberte možnost, která správně dokončí každý z následujících příkazů.
1.1) „Můžeme říci, že lithium, sodík a draslík ...
(A)... patří do stejného období. “
(B)... má stejné atomové číslo. “
(C)... patří do stejné skupiny. “
(D)... má stejné hromadné číslo. “
1.2) „Prvky lithium, sodík a draslík ...
(A)... má velmi podobné chemické vlastnosti. “
(B)… má velmi odlišné chemické vlastnosti. “
(C)… jsou nekovy. “
(D)... reagují s vodou za vzniku kyselých roztoků. “
Odpovědi:
1.1) (C) patří do stejné skupiny.
1.2) (A) má velmi podobné chemické vlastnosti.
Tuto informaci můžeme získat na základě periodické tabulky nebo elektronickým rozdělením prvků lithia, sodíku a draslíku. Uvidíme, že tři mají elektron ve valenčním plášti a protože jsou součástí stejné skupiny, chemické vlastnosti jsou velmi podobné.
3) Zvažte následující tabulku, kde jsou znázorněna atomová čísla a elektronická distribuce některých chemických prvků.
| Živel | chemický symbol | protonové číslo | Elektronická distribuce |
|---|---|---|---|
| Lithium | číst | 3 | 2,1 |
| Berýlium | být | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Hu | 10 | 2,8 |
| chlór | Cl | 17 | 2,8,7 |
| argon | Vzduch | 18 | 2,8,8 |
| Draslík | K. | 19 | 2,8,8,1 |
| Vápník | Tady | 20 | 2,8,8,2 |
Uveďte skupinu každého prvku.
Odpověď:
Lithium a draslík: skupina 1. (Mají elektron ve valenčním plášti).
Berylium a vápník: skupina 2. (Ve valenčním plášti mají dva elektrony).
Fluor a chlor: skupina 17. (Ve valenčním plášti mají sedm elektronů).
Neon a argon: skupina 18. (Ve valenčním plášti mají osm elektronů).
Zkontrolujte otázky přijímací zkoušky s komentovaným rozlišením v Cvičení na periodické tabulce a nepublikované otázky na toto téma v Cvičení z organizace periodické tabulky.