Prvky pojmenované po kovy alkalických zemin jsou ty, které patří do rodiny 2 nebo IIA, periodické tabulky. Tato skupina zahrnuje následující chemické prvky: Být (berylium), Mg (hořčík), Ca (vápník), Sr (stroncium), Ba (baryum) a radium (Ra).

Ve valenčním plášti mají dva elektrony a jejich obecné rozdělení je reprezentováno ns2, kde Ne představuje číslo poslední úrovně. Díky této vlastnosti mají tendenci tyto dva elektrony ztrácet, což vede ke vzniku 2+ nábojových kationů.
Termín „země“ označuje „existující na Zemi“, protože právě zde se tyto prvky nacházejí, zejména v minerálech. Například vápník ve formě sloučeniny fosforečnanu vápenatého (Ca3(PRACH4)2), nachází se v zemské kůře a slouží jako surovina pro výrobu fosforu. Je také přítomen v kostech zvířat, a to natolik, že při jejich kalcinaci se získá takzvaná „kostní moučka“, která obsahuje fosforečnan vápenatý.
Mezi kovy alkalických zemin nejvíce vynikají Vápník to je Hořčík.
- Vápník
Iont vápníku (Ca2+) je přítomen v asi 90% našich kostí a zubů; a u zvířat je také přítomen v jejich skořápkách. Jeho funkcí je posílit strukturu kostí a sloužit jako svalový relaxant. Nedostatek vápníku v těle může způsobit svalové křeče, tetanus a osteoporózu. Proto je důležité jíst jej prostřednictvím potravin bohatých na vápník, jako je mléko a jeho deriváty (máslo, sýr atd.), Maso a zelenina.
Na druhé straně může příliš mnoho vápníku způsobit uvolnění svalů, ledvinové kameny a bolest kostí.
Kromě výše zmíněných potravin je vápník stále přítomen v mnoha částech přírody, zejména v minerálech, jako je kalcit (CaCO3) nebo uhličitan vápenatý, který je složkou vápence a mramoru, a mramor se používá při výrobě dřezů, soch, podlah a schodišť. Uhličitan vápenatý je také stavitelem stalaktitů a stalagmitů v jeskyních. Vápník je také přítomen v přírodní sádře (CaSO4. 2 hodiny2O), nazývaný sádra. Tato sůl může být dehydratována, což vede k CaSO4 bezvodý, což je školní křída.
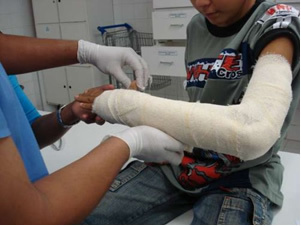
V průmyslu se vyrábí čerstvé vápno (CaO), hašené vápno, nazývané také hydratované vápno nebo hašené vápno, což je ve skutečnosti hydroxid vápenatý (Ca (OH)2), který se používá v bělících barvách a při přípravě malty. Mírné zahřátí sádry umožňuje získání hemihydrátu síranu vápenatého, což je sádra, která se používá ve stavebnictví občanské společnosti, při výrobě forem ve stomatologii a medicíně na ochranu zlomenin kostí, jako je ta na paži znázorněná níže.
- Hořčík
iont hořčík má také velký biologický význam, protože je přítomen v 70% našich kostí, protože podporuje působení enzymů, svalů a motorické koordinace. Jeho nedostatek v těle může způsobit dezorientaci, hypertenzi, třes a slabý puls. Proto bychom měli jíst následující potraviny, které tento prvek obsahují: ořechy, zrna a zelená zelenina. Přebytek hořčíku v těle může také způsobit ospalost.
Hořčík existuje také v mořské vodě a minerálech. Používá se v kovových slitinách, jako jsou obětované kovy (které oxidují místo oceli a zabraňují její korozi), v „hořčíkových“ kolech a v ohňostrojích (nabízející barvy stříbrná a bílá). Velmi důležitou sloučeninou hořčíku je hydroxid hořečnatý (Mg (OH)2), který při dispergaci ve vodě v koncentraci přibližně 7% vede ke známé suspenzi populárně jako magnéziové mléko, které slouží jako antacidum, bojuje s kyselostí žaludku (pálení žáhy) a jako projímadlo.

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/metais-alcalinoterrosos.htm
