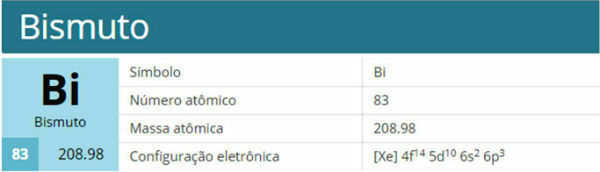
Vizmut je chemický prvek se symbolem Bi, atomovým číslem 83, atomovou hmotností 208,9 u. Patří do skupiny 15 a rodiny 5A.
V přírodě je vizmut vzácný, což zvyšuje jeho tržní hodnotu. Má několik typů použití v průmyslových odvětvích a dokonce i pro lidské zdraví.
Chemické a fyzikální vlastnosti
Vizmut je při pokojové teplotě pevný a má nízkou teplotu tání.
Je charakterizován jako křehký a křehký kov, s růžovým odstínem a duhovou barvou.
Je to nejvíce diamagnetický kov na periodické tabulce, což znamená, že je odpuzován silnými magnetickými poli.

V přírodě se kromě své elementární formy nachází také ve formě následujících minerálů: bismutinit (Bi2s3) a bismit (Bi2Ó3).
Lze jej také najít ve spojení se stříbrem, zinkem a olovem.
Mezi země s největším množstvím vizmutu patří Peru, Mexiko, Bolívie a Čína. V Brazílii je množství vizmutu extrémně nízké, což znemožňuje jeho využití.
Zvláštním rysem je, že navzdory tomu, že jde o těžký kov, jeho soli nepředstavují toxicitu a lze jej použít k mnoha činnostem.
Navzdory tomu může vizmut i jeho soli způsobit některé typy poškození jater. Může také zůstat v ledvinách po celá léta. Některé případy otravy vizmutem již byly hlášeny.
aplikace
Protože soli vizmutu nejsou toxické, používají se při výrobě léčivých přípravků a kosmetiky, jako jsou oční stíny, tvářenky a barvy na vlasy.
Důležitou farmaceutickou aplikací je složení léčiv pro potírání peptických vředů způsobených bakteriemi Helicobacter pylori.
Salicylát bismutitý se používá v lécích proti průjmům, bolestem žaludku a zažívacím potížím.
Vizmut se také používá při pájení a při výrobě kovových slitin. V tomto případě je smíchán s hliníkem, mědí nebo železem.
Díky nízké teplotě tání se používá v systémech protipožární ochrany. Jak teplota okolí stoupá, slitina bismutu kovu se roztaví a aktivuje systém uvolňování vody na místě.