Organické reakce jsou reakce, které probíhají mezi organickými sloučeninami. Existuje několik typů reakcí, ke kterým dochází rozbitím molekul a vznikem nových vazeb.
Široce používané v průmyslu, z nich lze mimo jiné vyrábět léky a kosmetické výrobky, plasty.
hlavní typy organických reakcí oni jsou:
- adiční reakce
- náhradní reakce
- eliminační reakce
- Oxidační reakce
Sčítací reakce
Adiční reakce probíhá, když se vazby organické molekuly rozbijí a přidá se k ní činidlo.
Stává se to hlavně ve sloučeninách, jejichž řetězce jsou otevřené a které mají nenasycení, jako jsou alkeny () a alkyny (
).
Příklady adičních reakcí
Příklad 1: hydrogenace (přidání vodíku)
Hydrogenací alkenu vznikne alkan.
Příklad 2: halogenace (přidání halogenů)
Halogenace alkenu produkuje halogenid.
Příklad 3: hydratace (přidání vody)
Hydratací alkenu vzniká alkohol.
Přečtěte si také: Organické sloučeniny
Náhradní reakce
Substituční reakce probíhá, když existují vazebné atomy (nebo skupina), které jsou nahrazeny jinými.
Stává se to hlavně mezi alkany, cyklány a aromaty.
Příklady substitučních reakcí
Příklad 1: halogenace (výměna halogenu)
Halogenace alkanu produkuje halogenid.
Příklad 2: nitrace (substituce nitro)
Nitrací alkanu vznikne nitrosloučenina.
Příklad 3: sulfonace (substituce sulfoniky)
Sulfonací alkanu vzniká kyselina.
Přečtěte si také: Organické funkce
Eliminační reakce
K eliminační reakci dochází, když se z organické molekuly odstraní uhlíkový ligand.
Tato reakce je v rozporu s adiční reakcí.
Příklady eliminačních reakcí
Příklad 1: eliminace vodíku (dehydrogenace)
Odstraněním vodíku z alkanu vznikne alken.
Příklad 2: eliminace halogenů (dehalogenace)
Eliminace halogenů z dihalogenidu produkuje alken.
Příklad 3: odstranění halogenidů
Odstraněním halogenidu z halogenidu se získá alken.
Příklad 4: vylučování vody (dehydratace alkoholem)
Odstraněním vody z alkoholu vznikne alken.
Podívejte se taky: esterifikace
Oxidační reakce
Oxidační reakce, nazývaná také redox, probíhá, když dochází k zesílení nebo ztrátě elektronů.
Příklady oxidačních reakcí
Příklad 1: energetická oxidace alkenů
Energetická oxidace alkenu produkuje karboxylové kyseliny.
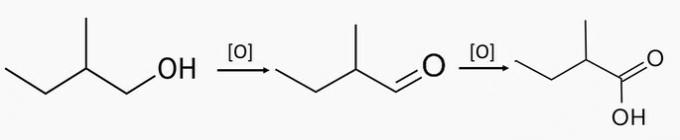
Příklad 2: primární oxidace alkoholu
Energetická oxidace primárního alkoholu produkuje karboxylovou kyselinu a vodu.
Příklad 3: sekundární oxidace alkoholu
Oxidací sekundárního alkoholu vzniká keton a voda.
Přečtěte si také: Karboxylové kyseliny
Cvičení z organických reakcí
Otázka 1
(Unifesp / 2002) Mnoho alkoholů lze získat kyselinou katalyzovanou hydratací alkenů.
V této adiční reakci se H ve vodě přidá k uhlíku, na který je připojeno více vodíků, a hydroxylová skupina je připojena k méně hydrogenovanému uhlíku (Markovnikovovo pravidlo).
Věděli jsme, že alkoholy vytvořené při hydrataci dvou alkenů jsou 2-methyl-2-pentanol a 1-ethylcyklopentanol, jaké jsou názvy odpovídajících alkenů, které je vedly?
a) 2-methyl-2-penten a 2-ethylcyklopenten.
b) 2-methyl-2-penten a 1-ethylcyklopenten.
c) 2-methyl-3-penten a 1-ethylcyklopenten.
d) 2-methyl-l-penten a 2-ethylcyklopenten.
e) 3-methyl-2-penten a 2-ethylcyklopenten.
Správná alternativa: b) 2-methyl-2-penten a 1-ethylcyklopenten.
2-Methyl-2-pentanolový alkohol se vyrábí hydratací 2-methyl-2-pentenalkenu.
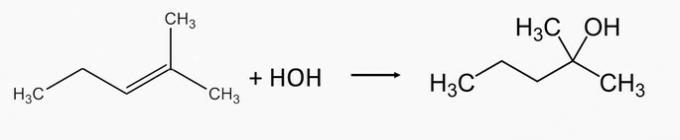
1-ethylcyklopentanolový alkohol se vyrábí hydratací 1-ethylcyklopentenalkenu.
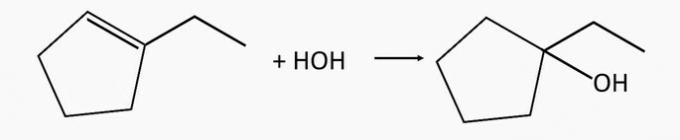
otázka 2
(Ufal / 2000) Při studiu chemie sloučenin uhlíku se zjistilo, že BENZEN:
() Je to uhlovodík.
() Lze získat z acetylenu.
() V oleji je to složka s větším hmotnostním podílem.
() Může podstoupit substituční reakci.
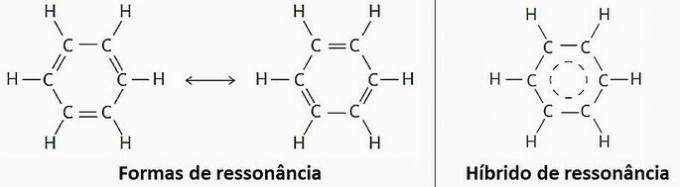
() Je to příklad molekulární struktury, která představuje rezonanci.
(SKUTEČNÉ) Benzen je aromatický uhlovodík. Tato sloučenina je tvořena pouze atomy uhlíku a vodíku, jejichž vzorec je C6H6.
(SKUTEČNÉ) Benzen lze z acetylenu vyrobit následující reakcí:
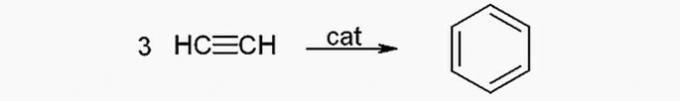
(FALSE) Ropa je směs uhlovodíků a hmotnost složek souvisí s délkou řetězce. Proto mají větší uhlíkové řetězce větší hmotnost. Nejtěžší frakce ropy, jako je asfalt, mají řetězce s více než 36 atomy uhlíku.
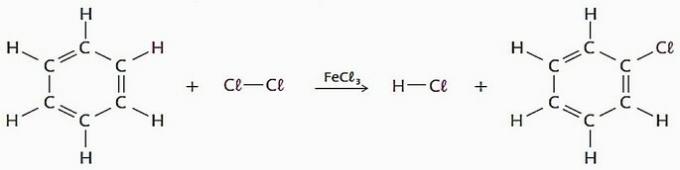
(PRAVDA) Substituční reakce používající benzen jako činidlo mají mnoho průmyslových aplikací, zejména pro výrobu léčiv a rozpouštědel.
V tomto procesu může být atom vodíku nahrazen halogeny, nitroskupinou (-NO2), sulfonová skupina (—SO3H), mimo jiné.
Podívejte se na příklad tohoto typu reakce.
(PRAVDA) Kvůli rezonanci může být benzen reprezentován dvěma strukturními vzorci.
V praxi však bylo pozorováno, že délka a energie vazeb vytvořených mezi atomy uhlíku jsou stejné. Proto je rezonanční hybrid nejblíže ke skutečné struktuře.
otázka 3
(UFV / 2002) Oxidační reakce alkoholu s molekulárním vzorcem C5H12O, s KMnO4 poskytla sloučenina molekulárního vzorce C5H10Ó.
Zaškrtněte možnost, která ukazuje SPRÁVNOU korelaci mezi názvem alkoholu a názvem vytvořeného produktu.
a) 3-methylbutan-2-ol, 3-methylbutanal
b) pentan-3-ol, pentan-3-on
c) pentan-1-ol, pentan-1-on
d) pentan-2-ol, pentanal
e) 2-methylbutan-l-ol, 2-methylbutan-l-on
Správná alternativa: b) pentan-3-ol, pentan-3-on.
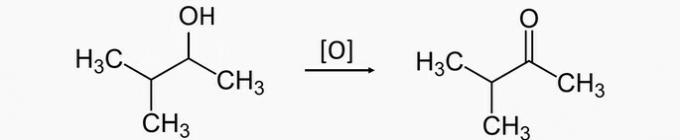
a) NESPRÁVNÉ. Oxidací sekundárního alkoholu se získá keton. Správným produktem pro oxidaci 3-methylbutan-2-olu je proto 3-methylbutan-2-on.
b) SPRÁVNĚ. Oxidací sekundárního alkoholu pentan-3-ol se získá keton pentan-3-on.

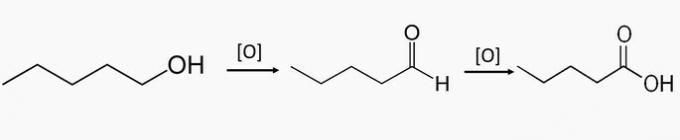
c) NESPRÁVNÉ. Tyto sloučeniny jsou součástí oxidace primárních alkoholů, při které vzniká aldehyd nebo karboxylová kyselina.
Pentan-1-ol je primární alkohol a částečnou oxidací sloučeniny může vznikat pentanal a celkovou oxidací se tvoří kyselina pentanová.
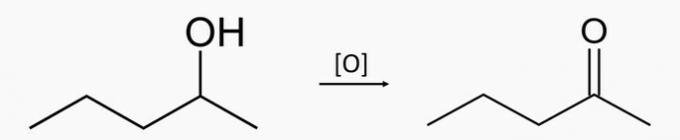
d) NESPRÁVNÉ. Oxidací sekundárního alkoholu pentan-2-ol se získá pentan-2-on keton.
e) NESPRÁVNÉ. Primární alkohol 2-methylbutan-1-ol produkuje aldehyd 2-methylbutanal v částečné oxidaci a kyselinu 2-methylbutanovou v celkové oxidaci.
otázka 4
(Mackenzie / 97) Při eliminační reakci, ke které dochází v 2-brombutanu s hydroxidem draselným v alkoholickém prostředí, se získá směs dvou organických sloučenin, které jsou pozičními izomery.
Jedním z nich, který se tvoří v menším množství, je 1-buten. Druhou je:
a) methylpropen.
b) 1-butanol.
c) butan.
d) cyklobutan.
e) 2-buten.
Správná alternativa: e) 2-buten.
Alkeny se vyrábějí reakcí organického halogenidu HBr s hydroxidem draselným KOH v přítomnosti ethylalkoholu jako rozpouštědla.

Různé sloučeniny vznikly díky tomu, že atom halogenu byl uprostřed uhlíkového řetězce, což generovalo více než jednu možnost eliminace.
Ačkoli existují dvě možnosti produktů, nebudou mít stejná množství.
2-Buten pro tuto reakci bude tvořen ve větším množství, protože pochází z eliminace terciárního uhlíku. 1-buten vznikl eliminací primárního uhlíku, a proto vzniklo menší množství.
