Chloridy jsou iontové sloučeniny, které obsahují anion Cℓ-1.
Chlór je z rodiny 17 nebo 7A, jeho atomové číslo se rovná 17 a má 7 elektronů ve valenčním plášti (nejvzdálenější elektronový obal atomu). Podle pravidlo oktetu, aby byl stabilní, musí mít v této poslední skořápce 8 elektronů, a proto musí přijmout ještě jeden elektron. Když k tomu dojde, to znamená, že když přijme elektron obecně z iontové vazby s kovem, vytvoří se â.chlorid nion (Cℓ-1), kov, který se vzdal elektronu, se stane kationtem a vytvořená látka je iontová.
Chloridy jsou soli odvozené z reakce báze s kyselinou chlorovodíkovou (HC2(tady)). Báze poskytuje kation a kyselina chlorovodíková poskytuje chloridový iont:
Obecná báze + kyselina chlorovodíková → Chlorid + voda
COH + HCℓ → CCℓ + H2Ó
Chloridy jsou klasifikovány jako anorganické soli, protože ve vodném prostředí uvolňují jiný kation než H+ a uvolní se chloridový anion, ne hydroxyl (OH-).
Nomenklatura chloridů se vždy řídí tímto pravidlem: Chlorid +de + (název prvku spojeného s chlorem).
Na vaše vzorce jsou vytvořeny výměna iontových nábojů za indexy (číslo, které je v pravém dolním rohu symbolu prvku, udávající počet atomů tohoto prvku, které jsou přítomny a vytvářejí vazby).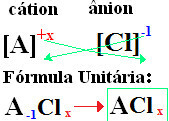
-li index je „1“, nemusíte jej zapisovat do vzorce, jak je znázorněno níže:
Na+1 Cℓ-1 → Na1Cℓ1 → NaC3: chlorid sodný;
K.+1 Cℓ-1 → K.C3: chlorid draselný;
Tady+2 Cℓ-1→CaCℓ2: chlorid vápenatý;
Ba+2 Cℓ-1→ Btady2chlorid barnatý;
Aℓ+3 Cℓ-1→ACℓ3: chlorid hlinitý.
Jak je však vysvětleno v textu „Iontové látky skupiny: chlorid, uhličitan, dusičnan a síran„Stejně jako u všech iontových látek nemají chloridy jednotné vzorce izolované v přírodě, protože jejich ionty se navzájem přitahují a vytvářejí krystalové mřížky.
Hlavním příkladem chloridu, který máme v každodenním životě, je chlorid sodný, NaCℓ, stolní sůl. Podívejte se na iontovou vazbu, která vede k její tvorbě (ve které sodík daruje elektron chloru) a pod krystalovou mřížkou této soli:
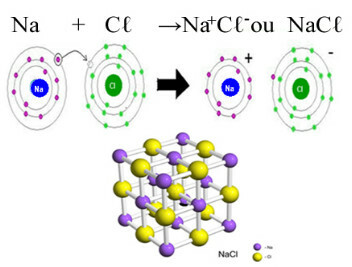
V krystalické mřížce chloridu sodného každý anion Cℓ- je obklopen 6 kationty Na+ a naopak, takže koordinační číslo této krystalové mřížky je 6.
Všechny chloridy jsou pevné látky v okolních podmínkách a docela rozpustné ve voděpatří mezi nejčastější soli vyskytující se v našem každodenním životě, vezmeme-li v úvahu několik z nich jsou přítomny rozpuštěné v minerální vodě, pitné vodě, vodovodní vodě, řekách, mořích ostatní. Mezi výjimky, které jsou ve vodě nerozpustné chloridy, patří chlorid stříbrný (AgCℓ - zobrazený na obrázku níže), z sloučeniny olova, mědi a rtuti.

Ve vodě nerozpustný chlorid stříbrný *
Ionty Cℓ-1 z chloridů, které přijímáme, hlavně v sůl, ryby a maso, jsou důležité pro některé funkce lidského těla, protože jsou hlavním extracelulárním aniontem, jsou přítomny ve šťávě žaludeční, regulují tělesné tekutiny, jako je distribuce vody v těle, a udržují plazmatický osmotický tlak a neutralitu elektrický.
Jeho nedostatek může způsobit úzkost, průjem a oběhové problémy. Jeho přebytek se vylučuje močí (v průměru každý člověk vylučuje asi 4 g chloridu denně), potem a výkaly.
*Kredit obrázku: Autor: Danny S. / Obrázek extrahován z: Wikimedia Commons
Autor: Jennifer Fogaça
Vystudoval chemii
