Uhlovodíky, také nazývané karbidy vodíku, jsou organické sloučeniny, jejichž složení má pouze atomy uhlík (C) a od vodík (H), tedy mající obecný vzorec CXHy.
Uhlovodík se skládá z uhlíkové struktury, ke které se atomy vodíku váží kovalentní vazba.
Je to nejdůležitější sloučenina v organické chemii.
Všechny typy uhlovodíků snadno oxidují, čímž uvolňují teplo. Většina z nich není rozpustná ve vodě.
Přírodní uhlovodíky jsou chemické sloučeniny vytvořené uvnitř Země (více než 150 km od hloubka) při vysokém tlaku a geologickými procesy dosahují zón nižšího tlaku.
Kde se nacházejí uhlovodíky?
Hlavním zdrojem uhlovodíků je ropa. Z tohoto důvodu je uhlovodík přítomen v několika derivátech, jako je petrolej, parafín, zemní plyn, Benzín, Vazelína, motorová nafta, LPG (Zkapalněný ropný plyn), polymery (jako je plast a guma).
Tato organická sloučenina tvoří 48% brazilské energetické matice.
Uhlíkový řetězec, který tvoří část složení uhlovodíku, je čtyřmocný, to znamená, že může vytvořit čtyři spojení.
Uhlík je schopen se vázat na jiné atomy uhlíku a na vodíky jednoduché odkazy, čtyřhra nebo trojnásobek.
Klasifikace uhlovodíků
Klasifikace uhlovodíků je založena na třech specifikách: a formulář hlavního uhlíkového řetězce, Připojení uhlíkových řetězců, přítomnost alkylových radikálů v uhlíkovém řetězci a přítomnost heteroatomů dělení uhlíkového řetězce.
vědět více o vodík.
Tvar hlavního uhlíkového řetězu
S ohledem na tvar hlavního uhlíkového řetězce je klasifikace uhlovodíků rozdělena na alifatický a cyklický.
Podívejte se, z čeho se každá z těchto forem uhlíkového řetězce skládá.
alifatické uhlovodíky
Alifatické uhlovodíky jsou tvořeny uhlíkovými řetězci otevřeno nebo acyklický. V těchto řetězcích jsou uhlíky terminály.
Příklady:
alkan
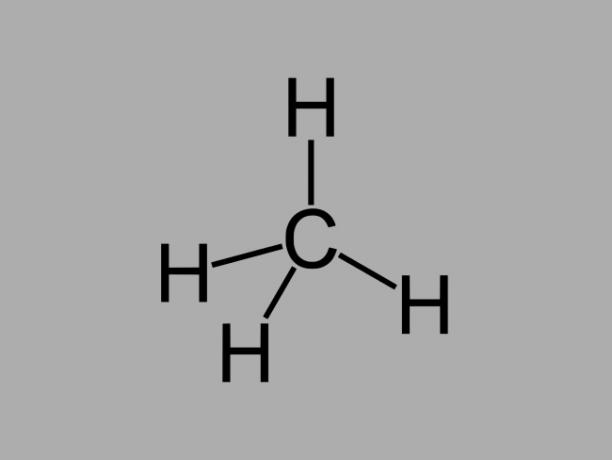
Alkanové uhlovodíky, také nazývané parafíny nebo parafinické, jsou olejovité sloučeniny, kde mezi uhlíky existují pouze jednoduché vazby.
Obecný vzorec pro alkan je CNeH2Ne + 2 (n = libovolné celé číslo).
alken
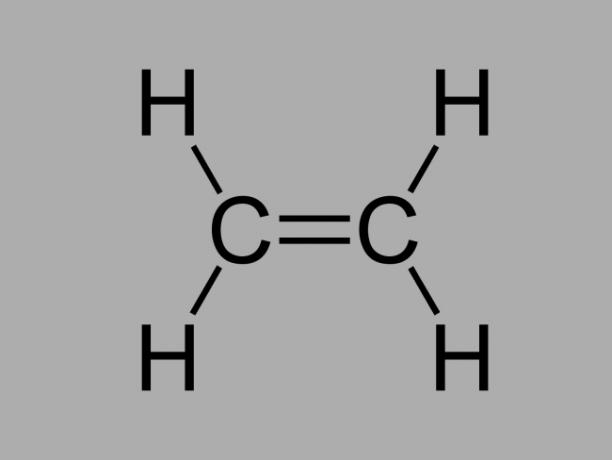
Také zvaný olefin, alken nebo ethylenový uhlovodík, alken je špatně reaktivní sloučenina, kde existuje dvojná vazba mezi uhlíky.
Obecný vzorec pro alken je CNeH2Ne.
alkyn
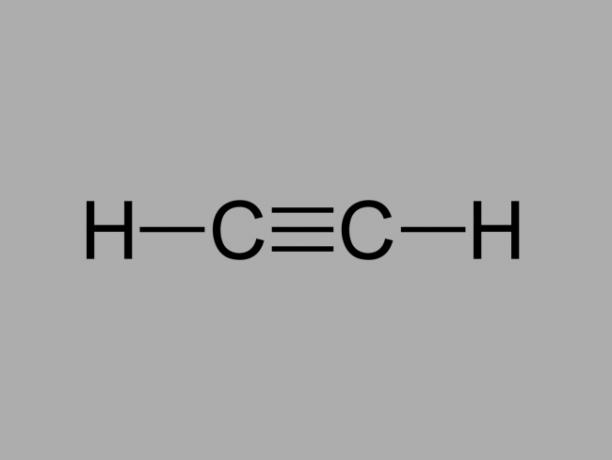
Také zvaný methylacetylen„Alkyn je uhlovodík, kde stávající vazby mezi uhlíky jsou trojné.
Obecný vzorec pro alkyn je CNeH2Ne-2.
alkadien

Alkadieny, které se také nazývají dieny nebo diolefiny, jsou uhlovodíky, kde jsou vazby mezi uhlíky dvojnásobné.
Obecný vzorec pro alkadien je CNeH2Ne-2.
Cyklické uhlovodíky
Cyklické uhlovodíky jsou tvořeny uzavřenými nebo cyklickými uhlíkovými řetězci. Tyto řetězy nemají koncové uhlíky.
Příklady:
Cyclan
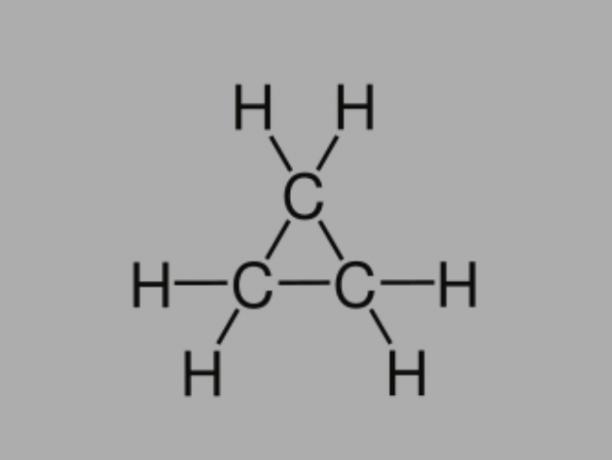
Také zvaný cykloalkan, cykloparafin nebo naftenický uhlovodík, cyklan je nasycený uhlovodík složený z jednoduchých vazeb.
Má uzavřený uhlíkový řetězec a jeho obecný vzorec je CNeH2Ne.
Cyklónský

Také zvaný cykloalkeny, cykleny jsou nenasycené uhlovodíky složené z dvojných vazeb.
Cyklén má uzavřený uhlíkový řetězec a jeho obecný vzorec je CNeH2Ne−2.
cyklista
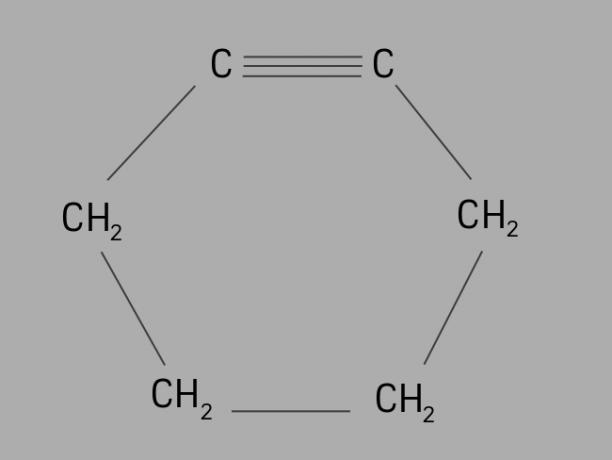
Také zvaný cykloalkyn nebo cykloalkyn, cyklin je cyklický a nenasycený uhlovodík.
Je tvořen uzavřeným uhlíkovým řetězcem s trojnými vazbami a jeho obecný vzorec je CNeH2Ne-4.
Aromatický

nebo

Také zvaný arény, aromatické uhlovodíky jsou nenasycené sloučeniny tvořené dvojnými vazbami.
Aromatická látka má uzavřený nebo cyklický uhlíkový řetězec a její obecný vzorec je C6H6.
Typ vazby uhlíkových řetězců
V závislosti na typu vazby uhlíkových řetězců lze uhlovodíky rozdělit na nasycený nebo nenasycené.
Níže se podívejte, z čeho se každá z těchto klasifikací skládá.
Nasycené uhlovodíky
Nasycené uhlovodíky jsou tvořeny jednoduché odkazy.
Příklady: alkany, cyklány.
nenasycené uhlovodíky
Nenasycené uhlovodíky jsou tvořeny dvojné vazby nebo trojnásobek.
Příklady: alkeny, alkyny, alkadiény.
Přítomnost alkylových radikálů
Pokud jde o přítomnost alkylových radikálů, mohou mít uhlovodíky uhlíkový řetězec normální nebo rozvětvený.
normální uhlíkový řetězec
Normální uhlovodíkový řetězec uhlovodíku nemá alkylové radikály.
Příklad: pentan
rozvětvený uhlíkový řetězec
Pokud má uhlovodík rozvětvený uhlíkový řetězec, znamená to, že jeho hlavní uhlíkový řetězec má alkylové radikály.
Příklad: methylpropan
Přítomnost heteroatomů dělících uhlíkový řetězec
Sekvenční uhlíkový řetězec může nebo nemusí být štěpen v závislosti na přítomnosti heteroatomů.
Homogenní uhlíkový řetězec
Pokud má uhlovodík homogenní hlavní uhlíkový řetězec, znamená to, že tento řetězec je není rozdělen heteroatomy.
Heterogenní uhlíkový řetězec
Pokud má uhlovodík heterogenní hlavní uhlíkový řetězec, měl tento řetězec svůj dělený uhlíkový řetězec heteroatomem.
Nomenklatura uhlovodíků
Nomenklatura uhlovodíků je definována kombinací tří částí:

Předpona označuje množství uhlíků, meziprodukt označuje typ vazby a přípona označuje funkci, ke které sloučenina patří (v tomto případě třída uhlovodíků).
Níže je uveden seznam předpon a meziproduktů, které jsou kombinovány k označení uhlovodíků.
Seznam předpon
| Počet uhlíků | Předpona |
|---|---|
| 1 | Se setkal- |
| 2 | Et- |
| 3 | Podpěra- |
| 4 | Ale- |
| 5 | pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Říjen |
| 9 | Ne- |
| 10 | Pro- |
Seznam zprostředkovatelů
| Typ připojení | Zprostředkovatel |
|---|---|
| Jen jednotlivé hovory | -an- |
| Pár | -en- |
| trojnásobný | -v- |
| dva páry | -dien- |
Podívejte se na několik příkladů pojmenování uhlovodíků.
Příklady:
CH3 - CH2 - CH2 - CH3
Ve výše uvedené strukturní formě vidíme 4-uhlíkovou sloučeninu, která má pouze jednoduché vazby (označené symbolem „-“).
- Předpona pro 4 uhlíky = but-
- Střední pro jednoduché vazby = -an-
- Přípona uhlovodíku = -o
Podívejte se, že spojení předpona + mezilehlé + přípona dává vzniknout jménu BUTAN.
CH2 = CH2
Výše uvedená strukturní forma má 2 uhlíky a 1 dvojnou vazbu (označeno symbolem „=“).
- Předpona pro 2 uhlíky = et-
- Meziprodukt pro dvojné vazby = -en-
- Přípona uhlovodíku = -o
Podívejte se, že spojení předpona + mezilehlé + přípona dává vzniknout jménu ETHENE.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
Pamatujte, že obě výše uvedené strukturní formy mají 4 uhlíky a 1 dvojnou vazbu (označeno symbolem „=“).
Máme tedy:
- Předpona pro 4 uhlíky = but-
- Meziprodukt pro dvojné vazby = -en-
- Přípona uhlovodíku = -o
Podívejte se, že spojení předpona + mezilehlé + přípona by dalo vzniknout jménu BUTENE pro tyto dvě strukturní formy.
Mějte však na paměti, že strukturní formy nejsou totožné, takže ani nomenklatury nemohou být.
Rozdíl mezi těmito dvěma strukturními formami spočívá v umístění dvojné vazby.
V tomto případě musíme číslovat uhlíky v řetězci od konce nejblíže k dvojitému. Proto v dotyčných případech musíme číslovat zleva doprava.
v CH2 = CH - CH2 - CH3:
- CH2 bude 1
- CH bude 2
- CH2 bude 3
- CH3 bude 4
Všimněte si, že dvojná vazba je mezi uhlík 1 to je uhlík 2.
K nalezení dvojné vazby musíme použít nejmenší číslo (1): BUTENE -1
v CH3 - CH = CH2 - CH3:
- CH3 bude 1
- CH bude 2
- CH2 bude 3
- CH3 bude 4
Všimněte si, že dvojná vazba je mezi uhlík 2 to je uhlík 3.
K nalezení dvojné vazby musíme použít nejmenší číslo (2): BUTENE -2
Podle IUPAC (Mezinárodní unie pro čistou a aplikovanou chemii - International Union of Pure and Applied Chemistry), místo by mělo být uvedeno těsně před být lokalizován (v případě strukturálních formálů výše dvojná vazba, představovaná meziproduktem „-En-“).
S tím máme druhý způsob, který je mimochodem nejsprávnější, psaní nomenklatury dostupných strukturních forem.
CH2 = CH - CH2 - CH3: BUTENE -1 nebo BUT-1-ENO (správnější forma)
CH3 - CH = CH2 - CH3: BUTENE -2 nebo BUT-2-ENE (správnější forma)
Dozvědět se víc o IUPAC a nomenklatura.