valenční vrstva je to nejvzdálenější vrstva (nebo úroveň) (nejvzdálenější od jádra) atomu, tj. nejvzdálenější od jádra. Proto má takzvané nejvzdálenější elektrony nebo valenční elektrony.
Počet úrovní, které může atom mít, se pohybuje od 1 do 7, které mají následující úrovně (žlutě):
úroveň K (1. vrstva): podúroveň s
úroveň L (2. vrstva): podúrovně s a P
úroveň M (3. vrstva): podúrovně s, P a d
úroveň N (4. vrstva): podúrovně s, P, d a F
úroveň O (5. úroveň): podúrovně s, P, d a F
Úroveň P (6. úroveň): podúrovně s, P a d
úroveň Q (1. vrstva): podúrovně s a P
Každá z podúrovní obsahuje jiný počet elektronů. Dívej se:
podúroveň s obsahuje maximálně 2 elektrony;
podúroveň p obsahuje maximálně 6 elektronů;
podúroveň d obsahuje maximálně 10 elektronů;
podúroveň f pojme maximálně 14 elektronů.
Pokud je tedy valenční skořápka určitého atomu M, maximální počet elektronů, který může být v něm přítomno 18 (2 elektrony z podúrovně s + 6 elektronů z podúrovně p + 10 elektronů z podúroveň d).
Chcete-li určit valenční obal atomu a kolik elektronů má, existují dva způsoby, a to:
→ Stanovení valenčního pláště a jeho počtu elektronů z elektronické distribuce
Elektronické distribuce jsou vždy prováděny prostřednictvím Linus Pauling diagram, zobrazené níže:

Znázornění diagramu Linuse Paulinga
Obyčejný protonové číslo (což udává počet elektronů v atomu), provedeme elektronickou distribuci. Například atom s atomovým číslem 50:

Elektronická distribuce atomu s atomovým číslem rovným 50
Analýzou výše uvedené distribuce zjistíme, že nejvzdálenější úroveň od jádra je 5. (úroveň N), ve které máme přítomnost 4 elektronů (dva v podúrovni s a 2 v podúrovni p).
→ Stanovení valenčního pláště a jeho počtu elektronů z Periodické tabulky
Tabulka je uspořádána do období (vodorovné sloupce), které označují počet úrovní atomu, a skupin nebo rodin (svislé sloupce). Období se používá k určení valenční vrstvaa rodiny se používají k určení počtu elektronů.
a) Znát periodu chemického prvku
Periodická tabulka představuje celkem sedm období, jejichž počet souvisí s počtem úrovní přítomných v diagramu Linuse Paulinga. Pokud tedy známe období, ve kterém chemický prvek je v tabulce automaticky, víme, kolik úrovní mají vaše atomy, valenční vrstva je nejvzdálenější od jádra.
1. Příklad: Chemický prvek Draslík
Draslík je umístěn ve čtvrtém období periodické tabulky, takže jeho atom má čtyři úrovně, čtvrtou úrovní je valenční vrstva, což je potvrzeno jejím rozložením elektronika.
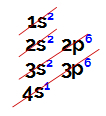
Elektronická distribuce prvku draslíku
2. Příklad: Chemický prvek Fluor
Fluor je umístěn ve druhé periodě periodické tabulky, takže jeho atom má dvě úrovně, druhou úrovní je valenční vrstva, což je potvrzeno jejím rozložením elektronika.

Elektronická distribuce fluorového prvku
3. příklad: Chemický prvek india
Nepřestávejte... Po reklamě je toho víc;)
Ind je umístěn v pátém období periodické tabulky, takže jeho atom má pět úrovně, pátou úrovní je valenční vrstva, což je potvrzeno jejím rozložením elektronika.

Elektronická distribuce prvku india
b) Znát rodinu nebo skupinu chemického prvku
Známe rodinu nebo skupinu, ve které je prvek umístěn, známe také počet elektronů přítomných ve valenčním obalu tohoto prvku.
Prvky rodiny A
Prvky rodin A jsou umístěny ve sloupcích 1, 2, 13 až 18 periodické tabulky. Každý z těchto sloupců přijímá číslo (1 až 8, římské číslo), které přesně označuje počet elektronů ve valenčním shellu těchto prvků:
Sloupec 1 - rodina IA = všechny mají ve valenčním shellu 1 elektron;
Sloupec 2 - rodina IIA = všechny mají ve valenčním plášti 2 elektrony;
Sloupec 3 - rodina IIIA = všechny mají ve valenčním shellu 3 elektrony;
Sloupec 4 - rodina IVA = všechny mají ve valenčním plášti 4 elektrony;
Sloupec 5 - VA rodina = všechny mají ve valenčním plášti 5 elektronů;
Sloupec 6 - rodina VIA = všechny mají ve valenčním shellu 6 elektronů;
Sloupec 7 - rodina VIIA = všechny mají ve valenčním shellu 7 elektronů;
Sloupec 8 - rodina VIIIA = všechny mají ve valenčním plášti 8 elektronů.
Podívejte se na několik příkladů stanovení počtu valenčních elektronů některých prvků rodiny A:
Příklad 1: chemický prvek barium
Barium se nachází v rodině IIA, takže má ve valenčním plášti dva elektrony, což potvrzuje jeho elektronická distribuce:

Elektronická distribuce barnatého prvku
Příklad 2: Antimonový chemický prvek
Antimon se nachází v rodině VA, takže má ve valenčním plášti pět elektronů, což potvrzuje jeho elektronická distribuce:

Elektronická distribuce prvku antimonu
Příklad 3: Xenonový chemický prvek
Xenon se nachází v rodině VIIIA, takže má ve valenčním plášti osm elektronů, což potvrzuje jeho elektronická distribuce.

Elektronická distribuce xenonového prvku
POZNÁMKA: Jediným chemickým prvkem patřícím do rodiny A, který nevyhovuje navrhovanému pravidlu, je hélium. Patří do rodiny VIIIA, ale ve valenčním plášti má pouze dva elektrony. Je to proto, že jeho atomové číslo je 2, takže je nemožné, aby měl ve valenčním plášti 8 elektronů jako ostatní prvky v rodině.
Elektronická distribuce atomu helia
Prvky rodiny B.
Prvky rodin B jsou umístěny ve sloupcích 3 až 12 periodické tabulky. Kromě rodin A existuje také osm rodin B, které jsou reprezentovány římskými číslicemi. Na rozdíl od rodin A počet rodin B neurčuje počet elektronů ve valenčním plášti.
Počet elektronů ve valenčním plášti prvku rodiny B se vždy rovná 2, bez ohledu na atomové číslo a pozici v tabulce. Elektronické distribuce kalifornia (98Srov.) A Hassius (108hs) prokázat toto:
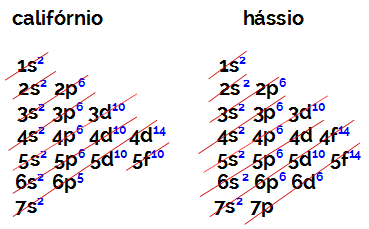
Elektronická distribuce kalifornia má jako nejenergetičtější podúrovni 5f10, a o Hassiova je 6 d6. V obou případech je nejvzdálenější podúrovní od jádra sedmá úroveň a oba mají dva distribuované elektrony.
Podle mě. Diogo Lopes Dias

