Když jsou dvě řešení smíchána, ať už se liší nebo ne, je nutné nejprve analyzovat, zda mezi nimi existuje reakce. Například pokud smícháme roztok vody s cukrem (vodný roztok sacharózy) s roztokem vody se solí (solankou), získáme míchání roztoků bez chemických reakcí.
Totéž se stane, pokud smícháme dva roztoky chloridu sodného (NaCl) s různými koncentracemi. V tomto případě také nedojde k žádné reakci. Tento příklad pak můžeme definovat jako a míchání roztoků stejné rozpuštěné látky bez jakékoli chemické reakce, kde prvním příkladem je a míchání roztoků různých rozpuštěných látek bez chemické reakce.
V obou případech se chemická složení složek roztoků nezmění.některé kvantitativní aspekty však bude nutné přepočítat.
Abychom pochopili, jak bychom mohli určit molární koncentraci (Molarity) a běžnou koncentraci směsi roztoků bez reakce, podívejme se na řešení dvou zmíněných případů:
1.) Směs roztoků stejné rozpuštěné látky, bez výskytu chemické reakce:

Představte si, že smícháme dva roztoky chloridu sodného, jeden s koncentrací 2,0 g / L v 60,0 ml roztoku a druhý s 2,5 g / L v 80 ml objemu roztoku.
Protože nedochází k žádné reakci, jak hmotnost, tak objem jsou pouze součtem počátečních hmot a objemů:
m (řešení) = m1 (NaCl) + m2 (NaCl)
m1 (NaCl) = v. Cm2 (NaCl) = v. C
m1 (NaCl) = 0,06 L. 2,0 g / l m2 (NaCl) = 0,08 litru. 2,5 g / l
m1 (NaCl) = 0,1 g2 (NaCl) = 0,2 g
m (roztok) = 0,1 g + 0,2 g
m (roztok) = 0,3 g
v (řešení) = v1 (NaCl) + v2 (NaCl)
v (roztok) = (60 + 80) ml
v (roztok) = 140 ml = 0,14 L
Koncentrace pak může být získána pomocí těchto údajů:
C (řešení) = m (řešení)
v (řešení)
C (řešení) = 0,3 g
0,14 litru
C (řešení)≈ 2,14 g / l
2.) Směs roztoků různých rozpuštěných látek, bez výskytu chemické reakce:
Vezměte například směs mezi 500 ml vodného roztoku sacharózy (C.12H22Ó11), který měl původně koncentraci 18,0 g / l, s 1 litrem solného vodného roztoku (vodný roztok chloridu sodného - NaCl) s koncentrací 100,0 g / l.
Nepřestávejte... Po reklamě je toho víc;)
Po promíchání, co se stalo molaritou, běžnou koncentrací, hmotou a objemem roztoku vzniklého ze směsi?
Protože nedošlo k žádné chemické reakci, masy C12H22Ó11 a NaCl zůstávají nezměněny. Počáteční hodnoty hmotnosti lze dosáhnout jednoduchým pravidlem tří pomocí reakčních koncentrací.
18,0 g 1 l
m (C12H22O11) 0,5 L
m (C.12H22Ó11) = 9,0 g
m (NaCl) 100,0 G
Hmoty lze dosáhnout také podle vzorce:
m = v. C
m (C.12H22Ó11) = 0,5 l 18 g / l
m (C.12H22Ó11) = 9,0 g
m (NaCl) = 1 l 100,0 g / l
m (NaCl) = 100,0 g
Celková hmotnost roztoku je tedy součtem dvou hmotností:
m (roztok) = m (C12H22Ó11) + m (NaCl)
m (roztok) = 109,0 g
Objem je jednoduše součtem počátečních objemů, takže máme:
v (konečné řešení) = v (C12H22Ó11) + v (NaCl)
v (konečné řešení) = (0,5 + 1) L
v (konečné řešení) = 1,5 l
Konečné koncentrace se dosáhne samostatným výpočtem koncentrací každé z rozpuštěných látek. Protože nereagují navzájem a jejich hmotnosti se nemění, můžeme použít následující koncentrační vzorec:
C = m
proti
počáteční = mpočáteční konečné c = mFinále
protipočáteční protiFinále
mpočáteční = mFinále
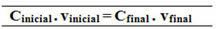
C (C.12H22Ó11) =?
Cpočáteční. protipočáteční = C.Finále. protiFinále
18,0 g / l. 0,5 l = C.Finále .1,5 l
C (C.12H22Ó11) Finále = 6,0 g / l
C (NaCl) =?
Cpočáteční. protipočáteční = C.Finále. protiFinále
100,0 g / l. 1 l = konečný. 1,5 l
C (NaCl)Finále = 66,67 g / l
Vztah vytvořený pro tento vzorec běžné koncentrace lze také provést pro výpočet molarity (Mi. protii = M.F. protiF) a pro hmotnostní koncentraci (název - Ti. protii = TF. protiF).
Autor: Jennifer Fogaça
Vystudoval chemii