Uhlík je chemický prvek s atomovým číslem (Z) rovným 6, což znamená, že atomy, které jej tvoří, mají v jádru šest protonů. Jeho molární hmotnost je 12 011 g / mol a v přírodě se nacházejí tři izotopy uhlíku, kterými jsou: o uhlík-12, uhlík-13 a uhlík-14. C-12 má v jádru šest protonů a šest neutronů a je nejhojnější.
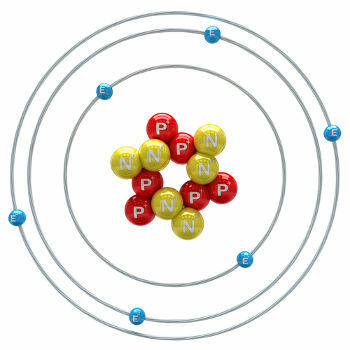
atom uhlíku-12
C-13 má sedm neutronů a je nejméně hojný (1,01 až 1,14%). C-14 má osm neutronů a je radioaktivní prvek který emituje β částice (elektrony) a tvoří se ve stratosféře Země, když neutrony kosmického záření bombardují dusík-14 přítomný v těchto horních vrstvách atmosféry. Je součástí všech rostlin a živočichů a s vědomím, že jeho poločas je asi 5730 let, se používá k určení stáří fosilií mezi 100 a 40 000 lety. Více podrobností o C-14 a datovací technice lze vidět v textu. Co je uhlík-14?
Uhlík je čtyřmocný, to znamená, že k dodržení pravidla oktetu potřebuje ve své valenční vrstvě (nejvzdálenější vrstvě) další čtyři protony. Proto obvykle vytváří čtyři kovalentní vazby, které sdílejí čtyři páry elektronů s dalšími prvky i jinými uhlíky. Tyto vazby mohou být jednoduché, dvojité nebo trojné a vedou k tvorbě milionů různých sloučenin. Z tohoto důvodu byla vytvořena oblast chemie,
Organická chemie, která studuje hlavní sloučeniny odvozené od uhlíku, s výjimkou některých případů minerálního původu, jako je např oxid uhličitý (CO2), O oxid uhelnatý (CO), O uhličitan vápenatý (CaCO3), hydrogenuhličitan sodný nebo hydrogenuhličitan sodný (NaHCO3), mezi ostatními. Tyto sloučeniny jsou studovány v Anorganická chemie.Uhlík provádí alotropii a tvoří jednoduché látky, tj. Látky, které jsou tvořeny pouze vazbami mezi atomy uhlíku. Existuje nejméně sedm allotropů uhlíku, kterými jsou grafit (alfa a beta), diamant, lonsdaleit (šestihranný diamant), chaoit, uhlík (VI) a fullereny. Ve skutečnosti existuje několik typů fullerenů, což jsou syntetické alotropní formy uhlíku. Mají polyedrickou strukturu s atomem uhlíku v každém vrcholu a příkladem je C60 volala buckminsterfullerenea jeho struktura vypadá jako fotbalový míč.
Nepřestávejte... Po reklamě je toho víc;)
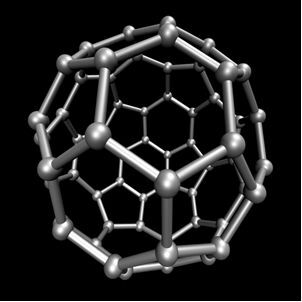
Carbon-60 (buckminsterfullerene)
Mezi těmito allotropy uhlíku však existují pouze dva přírodní. grafitTo je od diamant. Liší se pouze krystalickým uspořádáním atomů v prostoru, jak je znázorněno na obrázku níže, což má za následek zcela odlišné fyzikálně-chemické vlastnosti. Přečíst text uhlíková allotropy Pro více informací.

Dvě přírodní alotropní formy uhlíku jsou grafit a diamant.
Další syntetickou alotropní formou uhlíku je nanotrubice (obrázek níže), které mají široké biologické využití, včetně lékařské diagnostiky a léčby.

Ilustrace mikroskopické uhlíkové nanotrubice
Tím pádem, uhlík je přítomen ve všem kolem nás a v nás, protože komponuje přírodní organické sloučeniny - jako jsou fosilní paliva, mezi něž patří ropa, uhlí a zemní plyn, a další paliva, jako je ethanol a biopaliva - mimo jiné zemědělské produkty. tvar taky syntetické organické sloučeniny, jako jsou syntetická vlákna, z nichž se vyrábějí látky, léky, polymery, z nichž se skládají plasty a gumy, insekticidy, barviva a mnoho dalšího. V nás, zvířatech a zelenině, tvoří uhlík velmi důležité sloučeniny, jako jsou sacharidy, jako je cukr, glukóza a celulóza; proteiny, které tvoří například DNA, a společně s lipidy tvoří membrány červených krvinek a bílých krvinek.
To vše ukazuje na důležitost uhlíku pro udržení života. Ale také to bylo spojeno s negativními aspekty, jako je intenzifikace skleníkový efekt a následné globální oteplování, je to proto, že hlavním darebákem těchto problémů je jeho sloučenina oxidu uhličitého (CO2). Hlavně kvůli velkému spalování fosilních paliv, která uvolňují tento plyn, koncentraci CO2 v atmosféře se zvýšil. Jako skleníkový plyn způsobuje zmíněné problémy. Na druhé straně je oxid uhličitý také přítomen v životně důležitých reakcích, jako je fotosyntéza a dýchání.
Autor: Jennifer Fogaça
Vystudoval chemii