Může se stát, že existují kyseliny stejného prvku a tento prvek má stejné oxidační číslo (NOX), ale rozdíl je ve stupních hydratace.
Například níže máme tři kyseliny tvořené prvkem fosfor (P):
H3PRACH4 H4P2Ó7 HPO3
Všimněte si, že ve všech třech kyselinách je oxidační číslo fosforu +5; rozdíl je ve stupni hydratace.
Na základě toho se tyto kyseliny rozlišují v nomenklatuře pomocí předpon ortho, pyro a meta.
Nejvíce hydratovaná kyselina se nazývá ortho. V uvedeném příkladu první (H3PRACH4) je nazýván kyselina orthofosforečný, protože je nejvíce hydratovaný ze všech tří. Orto prefix je postradatelný, takže většinu času bude tato kyselina jen volána kyselina fosforečná.
Předpony pyro a meta se používají jako referenční bod s kyselinou orto:
Nepřestávejte... Po reklamě je toho víc;)
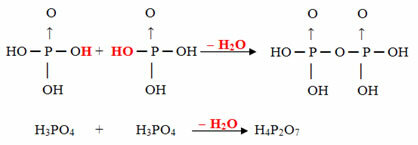
- Pyrus: 2 molekuly ortho minus 1 molekula H2Ó
Příklad: The H4P2Ó7 je nazýván kyselina pirofosforečný protože se rovná dvěma molekulám kyseliny ortofosforečné (H3PRACH4) minus jedna molekula vody.
2. H3PRACH4 = H6P2Ó8
H6P2Ó8 - H2O = H4P2Ó7
Tento proces je a intermolekulární dehydratace:
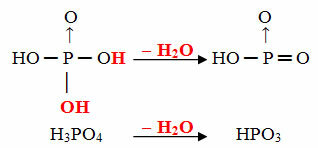
- Cíl: 1 molekula orto minus 1 molekula H2Ó
Příklad: HPO3 je nazýván kyselina fotbalová brankafosforečný protože se rovná molekule kyseliny ortofosforečné (H3PRACH4) minus jedna molekula vody.
H3PRACH4 - H2O = HPO3
Tento proces je a intramolekulární dehydratace:
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Stupeň hydratace kyselin“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm. Zpřístupněno 28. června 2021.
Kyselina ortofosforečná má následující molekulární vzorec: H3PRACH4. Odtud označte alternativu, která označuje kyselinu pyrofosforečnou a kyselinu metafosforečnou:
Stupeň ionizace, kyselina chlorovodíková, těkavost, kyselina octová, Svante Arrehenius, kyseliny vedou elektřinu, neutralizační reakce, reakce s uhličitany a hydrogenuhličitany, roztok červeného fenolftaleinu, lakmusový papír modrý.