Pro pochopení fenoménu ionizace nejprve je nutné vědět, co jsou ionty. Všimněte si níže uvedeného vysvětlení:
Každý atom má stejný počet protonů a elektronů; proto je každý atom elektricky neutrální. Kromě toho mají látky tvořené skupinami atomů také rovnováhu elektrického náboje a jsou elektricky neutrální.
nicméněatom nebo skupina atomů může ztratit nebo získat elektrony; když k tomu dojde, ztratí neutralitu a stanou se ionty.
Pokud atom nebo skupina atomů ztratí elektrony, bude kladně nabitý a bude nazýván iontem kation. Pokud však získáte elektrony, náboj bude záporný a iont bude a anion.
Anorganické látky jsou iontové nebo mají schopnost tvořit ionty.
Jedním ze způsobů, jak tvořit ionty, je umístění molekulárních látek do vody, tj. Tvořené kovalentními vazbami, ve kterých jsou sdíleny elektrony.
Například pokud testujeme elektrické vedení kyseliny chlorovodíkové (HCl) ve vodném roztoku (chlorovodík rozpuštěný ve vodě), uvidíme, že roztok je elektrolytický, to znamená, že vede elektrický proud, protože v tomto jsou ionty řešení.

To znamená, že voda působila jako reaktant a tvořila ionty z kyseliny chlorovodíkové. K tomu dochází podle níže uvedené reakce:
Nepřestávejte... Po reklamě je toho víc;)
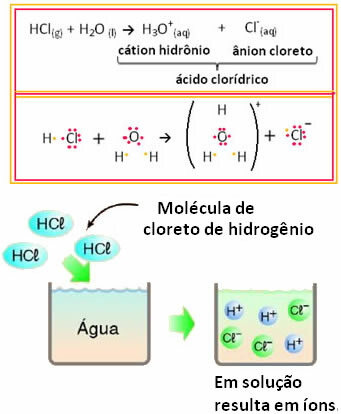
Všimněte si, že před vložením chlorovodíku do vody nebyly žádné ionty. Jeho molekuly však reagovaly s vodou a vytvářely pozitivní ionty H.3Ó+ (kationty) a negativy Cl- (anionty). Vzhledem k tomu, že chlor je více elektronegativní než vodík, přitahuje pár elektronů z blízké kovalentní vazby a tvoří anion. Vodík je naopak přitahován kyslíkem ve vodě, který je více elektronegativní než chlor; a mezi vodíkem a kyslíkem se vytvoří kovalentní vazba, která vede k hydroniovému kationtu. Tento jev tvorby iontů se nazýváionizace.
Na základě výše uvedeného vysvětlení můžeme definovat ionizaci následovně:

Všimněte si, že ionty dříve neexistovaly, protože pokud by existovaly, jako v případě rozpouštění iontových sloučenin, měli bychom iontovou disociaci a ne ionizaci.
Všechny kyseliny uvedené do styku s vodou procházejí ionizací. Ne každá molekulární sloučenina však prochází ionizací.Například cukr (C12H22Ó11) je molekulární, avšak při umístění do vody se netvoří žádné ionty, pouze se rozpouští a vzniká neelektrolytický molekulární roztok, který nevodí elektřinu.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Ionizace“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/ionizacao.htm. Zpřístupněno 28. června 2021.


