baterie je zařízení, ve kterém je elektrický proud vyráběn z chemické energie přicházející z a oxidoredukční reakce, tj. Jeden druh reaktantu ztrácí elektrony (oxidací), zatímco jiný druh získává elektrony (redukcí).
Podívejte se na reprezentace oxidačních a redukčních reakcí, ke kterým dochází v jakémkoli zásobníku:
Oxidace: X → a + X+
Druh X ztratí elektron a změní se na kation.
Snížení: Y- + a → Y
anion Y.- získává elektron a transformuje se do neutrálního druhu Y.
Základní součásti stohu
Základní komponenty zásobníku jsou:
Anoda: záporná elektroda, ve které probíhá oxidační reakce, tj. Ztráta elektronů;
Katoda: kladná elektroda, ve které probíhá redukční reakce, tj. Elektronový zisk;
Elektrolytický roztok (solný můstek) nebo vodivý materiál (například grafitová tyč): je prostředek, kterým se elektrony vzdané anodou dostanou na katodu.
Základy fungování baterie
Fungování zásobníku nastává z následujících událostí:
1. princip: Oxidace anody
Kov v anodě, protože má větší tendenci ztrácet elektrony, se stává kationtem, jak vidíme v rovnici níže:
Zn → Zn2+ + 2 a
2. princip: redukce katody
Kationty, které jsou součástí materiálu přítomného v katodě (jako příklad použijeme měď), při přijímání elektrony z anody se transformují na kovovou měď, jak vidíme na rovnici níže:
Osel2+ + 2e → Cu
první hromady
a) Baterie Alessandra Volty
Alessandrova hromada zpět (první hromada v historii), sestavená v roce 1800, byla vytvořena interkalovanými kovovými disky, jako na obrázku níže:

Sestavení podobné Alessandrově Zpět na váš stack
Záznamy byly prokládány, protože měly odlišné složení. Jeden byl vyroben z kovového zinku a druhý z mědi, který byl vždy oddělen bavlnou namočenou ve slaném nálevu (roztok tvořený vodou a solí).
B) Daniellina hromada
Daniellina hromada, sestavená v roce 1836, se skládala ze dvou poločlánků spojených vodivým drátem a solným můstkem.
Půlčlánek 1: byla to anoda, tj. záporný pól baterie.
Skládal se ze zinkové desky a část této desky byla ponořena do roztoku tvořeného vodou a síranem zinečnatým (ZnSO4).
Poloviční buňka 2: byla to katoda, tj. kladný pól baterie.
Skládal se z měděné desky a část této desky byla ponořena do roztoku tvořeného vodou a síranem měďnatým (CuSO4).
solný most
Trubka ve tvaru U, která obsahovala roztok tvořený vodou a chloridem draselným (KCl), který spojoval dva poločlánky (zinek a měď) a na obou koncích měl skleněnou vlnu.
baterie v současné době
V současné době existuje několik modelů zásobníků, ale obecně vypadají takto:
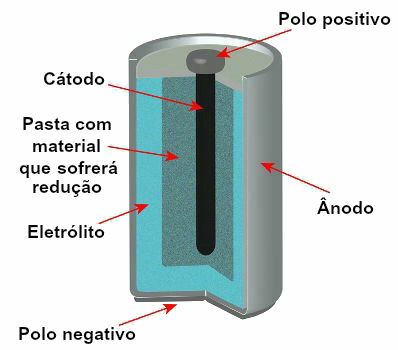
Schematické znázornění modelu aktuálního zásobníku
Nejpoužívanějšími modely jsou takzvaná baterie Leclanché a alkalická baterie, které mají následující rozdíly:
The) Leclanche hromada
Má anodu tvořenou kovovým zinkem;
Má katodu tvořenou pastou s chloridem amonným, vodou, škrobem a oxidem manganičitým;
Má grafitovou tyč, která slouží jako vodič pro elektrony, které se odchylují od katody směrem k anodě.
B) Alkalická baterie
Má anodu tvořenou kovovým zinkem nebo kadmiem;
Má katodu tvořenou oxidem rtuti, oxidem niklu a jodem;
Musí mít smíšenou základnu v materiálu, který tvoří katodu.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm


