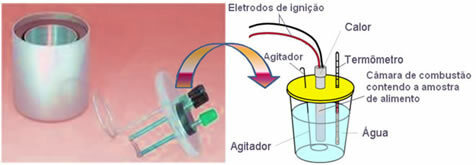
Množství kalorií závisí na složení jídla. K experimentálnímu určení množství tepla uvolněného potravou, které může být absorbováno tělem, používáme zařízení zvané kalorimetr.
Toto zařízení měří teplo uvolněné z jídla při jeho spalování. Existuje několik typů kalorimetrů; první z nich byla vytvořena v roce 1780 Lavoisierem a Laplaceem a byla ledový kalorimetr.
V dnešní době je nejpoužívanější a která zohledňuje výše kalorický koncept kalorií vodní kalorimetr. Toto zařízení je potaženo izolačním materiálem, aby se zabránilo tepelným ztrátám z média; a jídlo, které má být analyzováno, je umístěno do spalovací komora, který obsahuje plynný kyslík a elektrody. Tyto elektrody procházejí elektrickým výbojem a způsobují jejich vznícení a spalování potravin.
Známá hmotnost vody obsažená v kalorimetru absorbuje teplo uvolněné spálenou potravou a a teploměr měří zvýšení teploty vody. Kalorimetr navíc obsahuje a míchačka což umožňuje, aby teplota vody zůstala po celou dobu stejnoměrná.
Pokud tedy použijeme například hmotu 1 gramu cukru a kalorimetr má 1000 g vody, zjistíme, že nakonec reakce teplota vody klesla z 20 ° C na 24 ° C, to znamená, že se zvýšila o 4 ° C, pak můžeme dosáhnout energetické hodnoty cukr. Jako? Vzhledem k počáteční koncepci kalorií máme:
| Zvyšte od 1 ° C → 1 kcal na gram vody |
| Zvyšte ze 4 ° C → 4 kcal na gram vody |
Takže 1 g vody absorbuje 4 vápno. Bylo však použito 1 000 g vody a vzhledem k tomu, že veškeré teplo uvolňované při spalování bylo absorbováno, byla celková energie absorbovaná vodou 4000 kcal nebo 4 kcal. Proto dochází k závěru, že:
Nepřestávejte... Po reklamě je toho víc;)
| Energetická hodnota cukru = 4000 kcal / g nebo 4 kcal / g. |
Transformace na SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Kromě toho můžeme použít následující rovnici pro výpočet množství tepla odevzdaného nebo absorbovaného vodou:
| Q = m. C. t |
Kde:
Q = teplo odevzdané nebo absorbované vodou;
m = hmotnost vody;
c = měrné teplo vody, které se rovná 1,0 cal / g. ° C nebo 4,18 J / g. ° C;
Δt = změna teploty, kterou voda trpí, která je dána poklesem konečné teploty o počáteční (tF - ti).
Pomocí tohoto vzorce získáme stejný výsledek:
Q = m. C. t
Q = 1000 g. 1,0 kcal / g. ° C. (24-20) ° C
Q = 4000 kal
Q = 4,0 kcal
nebo
Q = m. C. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Měření potravinových kalorií pomocí kalorimetru"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm. Zpřístupněno 27. června 2021.