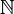THE Elektrochemie je obor fyzikální chemie, který studuje reakce, při kterých dochází k přenosu elektronů (oxi-redukční reakce) a jeho přeměna na elektrickou energii, stejně jako opačný proces, tj. přeměna elektrické energie na energii chemie.
Prvním procesem je to, co se odehrává v EU Baterie. Baterie jsou zařízení tvořená dvěma elektrodami (kladným pólem, kterým je katoda, a záporným pólem, kterým je anoda), navíc k elektrolytu (vodivý roztok). Elektrony jsou přenášeny externím vodičem z anody na katodu a tvoří elektrický proud, který se používá k zapnutí některého zařízení. Baterie se skládají z několika článků zapojených do série nebo paralelně.
Jedná se o spontánní proces a dodává se energie, dokud není chemická reakce vyčerpána (jako je tomu v případě primárních článků a baterií, jako je suchý článek Leclanché a baterie alkalické), nebo v případě reverzibilních reakcí lze použít potenciální rozdíl a reakci zvrátit, znovu vytvořit reaktanty a dobít baterii, která je připraven k opětovnému použití (to je případ baterií a sekundárních baterií, jako jsou olovo, používané v automobilech, a lithium-iontové, používané v zařízeních mobily).

Primární články a baterie v popředí a ve druhém dobíjení sekundárních baterií (olověné a lithium-iontové)
Nepřestávejte... Po reklamě je toho víc;)
Opačný proces není spontánní a je vyvolán elektrolýza. Elektrolýza je přechod elektrického proudu přicházejícího z generátoru, jako je článek nebo baterie, iontovou kapalinou. Pokud je kapalinou nějaká roztavená látka, máme a magmatická elektrolýza, ale pokud je to vodný roztok, máme vodná elektrolýza.
Když prochází elektrický proud kapalným médiem, generátor „táhne“ elektrony z kladného pólu (anoda - je to opak baterie) elektrolytického článku a přenáší je na záporný pól (katodu), to znamená, že katoda prochází redukcí a anoda prochází oxidace. Elektrická energie dodávaná generátorem se tedy transformuje na redoxní reakce (chemická energie). Níže je schéma elektrolýzy vody:

Schéma elektrolýzy vody
Elektrolýza se široce průmyslově používá při výrobě důležitých látek, jako je hliník, plynný chlór, kovový sodík, a k čištění nebo ochraně různých kovů, jako při galvanickém pokovování nebo při galvanickém pokovování, které spočívají v potažení nějakého předmětu kovem, jako je postříbření, pokovení mědí, pokovení niklem, zlacení a chromace; když je ocel potažena zinkem, nazývá se to galvanizace.
V sekci Elektrochemie na našich webových stránkách najdete více podrobností o všech aspektech týkajících se článků a baterií, jakož i elektrolýzy.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Co je to elektrochemie?“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm. Zpřístupněno 27. června 2021.
Chemie

Elektrolýza, roztoky elektrolytů, elektrický proud, oxidačně-redukční reakce, spontánní chemický proces, chemický proces spontánní, transformátor, umělá transformace, průmyslová odvětví, alkalické kovy, alkalické zeminy, plynný vodík, plyn tř