anorganické soli jsou tvořeny iontovou asociací alespoň jednoho kationtu (tvořeného jakýmkoli kovem nebo amoniem) a aniontu (jednoduchého nebo sloučeného).

Obecný molekulární vzorec soli
Po přidání do vody se soli disociují a uvolňují alespoň jeden kationt jiný než hydronium (H+) a aniont jiný než hydroxid (OH.)-).

Disociační rovnice pro jakoukoli sůl
Klasifikace solí
Soli mohou obecně mít následující klasifikace:
jednoduchá sůl: sůl tvořená pouze jedním kationtem a jedním aniontem. Příklady: NaCl, CaSO4, KCN, NH4CO3 atd.
Hydrogenovaná sůl: má dva kationty (z nichž jeden musí být hydronium) a anion. Příklady: NaHCO3, CaHBO3 atd.
Hydroxylová sůl: má kation a dva anionty (z nichž jeden musí být hydroxid). Příklady: MgOHCl, Al (OH)2ClO3 atd.
Hydratovaná sůl: představuje molekuly vody spojené s jeho krystalickou strukturou. Příklady: CaCl2.2H2O, CuSO4.6H2Atd.
Podvojná sůl: má dva kationty (všechny odlišné od hydronia) a jeden anion nebo jeden kation a dva anionty (všechny odlišné od hydroxidu). Příklady: Typ4CN, AgFeBO3 atd.
Kamenec: je sůl tvořená dvěma sulfáty s kationty NOx rovnými +1 a +3 plus 24 molekul vody. Příklady: Ag2POUZE4. Al2(POUZE4)30,24 hod2na2POUZE4.Sb2(POUZE4)30,24 hod2Ó
Pravidlo pojmenování soli
Název anionu + název de + kationtu
→ K.3PRACH4
Sůl má fosfátový anion (PO4-3) a draselný kation (K.+1), proto se jmenuje fosforečnan draselný.
→ Případ3
Sůl má siřičitanový anion (SO3-2) a kationt vápníku (Ca+2), proto se jmenuje siřičitan vápenatý.
POZNÁMKA: Pokud kation není stříbro, zinek nebo prvek, který patří do rodin IA, IIA a IIIA, musíme označit jeho NOX římskou číslicí před jménem kationtu.
→ Cu2POUZE4
Sůl má síranový anion (SO4-2) a kationt vápníku (Cu+1), proto se jmenuje síran měďnatý I.
Hydrogenovaná sůl: U této soli musíme před název aniontu napsat předponu týkající se množství vodíku ve vzorci. Tato předpona musí být oddělená od slova vodík pomlčkou.
→ NaHCO3
Sůl má hydrogenuhličitanový anion a kation sodný, takže se jmenuje monohydrogenkarbonát sodný.
Hydroxylová sůl: U této soli musíme před název aniontu napsat předponu odkazující na množství hydroxylových skupin ve vzorci. Tato předpona musí být oddělená od slova hydroxy pomlčkou.
→ Al (OH)2ClO3
Sůl má dva hydroxyly, chlorečnanový anion a kation hliníku, takže se jmenuje dihydroxy-chlorečnan hlinitý.
Nepřestávejte... Po reklamě je toho víc;)
Hydratovaná sůl: U této soli musíme za název kationu napsat předponu týkající se množství molekul vody ve vzorci. Tato předpona musí být oddělená od slova hydratovaný pomlčkou.
→ CaCl2.2H2Ó
Sůl má dvě molekuly vody, chloridový anion a vápenatý kation, takže se jmenuje dihydrát chloridu vápenatého.
Podvojná sůl se dvěma kationty: U této soli musíme napsat dvojité slovo v závorkách za názvem anionu a poté za nejelektropozitivnější název kationtu a druhý kation.
→ AgFeBO3
Tato sůl má kromě borátového aniontu také stříbro (více elektropozitivní kation) a kation železa II. Jeho název je boritan (dvojitý) stříbra a železa II.
-
Podvojná sůl se dvěma anionty:
Název nejvíce elektronegativního anionu + spojovník + název nejméně elektronegativního anionu + název de + kationtu
→ Typ4CN
Tato sůl obsahuje kationt titanu IV, kromě fosforečnanu (elektronegativnější anion) a kyanidového aniontu. Jeho název je kyanid titaničitý fosfát IV.
Kamencová sůl: U této soli ignorujeme obecné pravidlo. Stačí napsat výraz kamenec následovaný názvem kationu náboje +3 a názvem kationu náboje +1, odděleny spojkou e.
→ V2POUZE4.Sb2(POUZE4)30,24 hod2Ó
Kamenitá sůl má kation +3 antimon a kation +1 sodík, takže se jmenuje kamenec a antimon III.
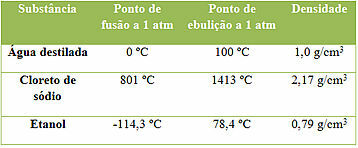
Fyzikální vlastnosti solí
Jsou pevné při pokojové teplotě;
Mají vysokou teplotu tání a teplotu varu;
Jsou vytvořeny z iontových vazeb;
Vedou elektrický proud v kapalném stavu (po fúzi) nebo po rozpuštění ve vodě;
Obecně lze říci, že jsou rozpustné ve vodě, ale existují i soli, které jsou považovány za prakticky nerozpustné.
Chemické vlastnosti solí
Soli jsou sloučeniny, které mají schopnost chemicky reagovat (za předpokladu, že nemají stejný kation nebo stejný anion jako jiná látka) s několika skupinami látek, a to:
Při dvojité výměnné reakci s kyselinou tvoří novou sůl a novou kyselinu.
Při dvojité výměnné reakci s bází: tvoří novou sůl a novou bázi.
V reakce dvojité výměny s jinou solí: tvoří dvě nové soli.
Některé soli mají schopnost trpět rozklad když je vystaven teplu, tvoří dvě nebo více nových látek. Pokud zahřeme hydrogenuhličitan sodný (NaHCO3), například se rozloží a vytvoří uhličitan sodný (Na2CO3), voda (H2O) a oxid uhličitý (CO2).
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Co jsou anorganické soli?“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm. Zpřístupněno 28. června 2021.
Co je to chemie?

Přístup k tomuto odkazu a seznámení se s tím, co je oxid, způsob identifikace této důležité skupiny anorganických látek a také pravidla pojmenování použitá k jejich pojmenování a hlavní klasifikace (dvojitá, kyselá, zásaditá, amfoterní a neutrální), které mohou dostávat.
Chemie

Sal Light, složený z chloridu sodného a chloridu draselného, pacient s vysokým krevním tlakem, nízkým obsahem sodíku, kovový sodík, kuchyňská sůl, sodné ionty.
Chemie

Každodenní soli, uhličitan vápenatý, chlorid sodný, fluorid sodný, dusičnan draselný, dusičnan sodný sodík, uhličitan sodný, hydrogenuhličitan sodný, hydrogenuhličitan sodný, siřičitan sodný, ledek, soda.