Oxidy kyselin jsou ty oxidy, které při reakci s vodou produkují kyselinu jako produkt. Při reakci s bází budou produkty solí a vodou.
Tyto sloučeniny mají obvykle kovalentní charakter, to znamená, že jsou molekulární, rozpustné ve vodě a tvořené většinou nekovy, což jsou prvky s vysokou elektronegativitou. Jsou-li tvořeny kovy, mají vysoké oxidační číslo (elektrický náboj).
Příklady:
CO2, POUZE2, POUZE3, P2Ó5, Cl2Ó6, NA2, Ne2Ó4, Ne2Ó5, atd.
Následuje obecné schéma charakteristických reakcí pro oxidy kyselin a příklad:
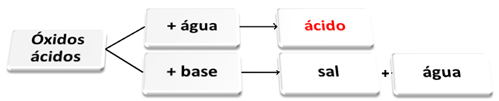
Oxidy kyselin reagují s vodou a s bází
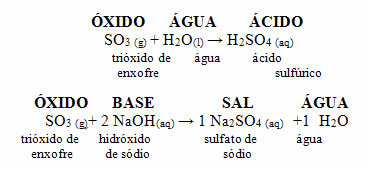
Oxidy kyselin se také nazývají anhydridy, protože toto slovo pochází z řečtiny anhydros, což znamená "žádná voda"a oxidy kyselin lze považovat za „bezvodou kyselinu“.
Vlastnosti a aplikace některých oxidů kyselin:
• Oxid uhličitý (oxid uhličitý) - CO2:
Tato sloučenina se používá jako plyn v nealkoholických nápojích a v minerálních vodách, protože když je vystavena vysokému tlaku, stává se rozpustnou ve vodě. Produkuje v těchto produktech kyselé médium, protože jde o kyselý oxid, který reaguje s vodou za vzniku kyseliny podle níže uvedené reakce:

Pod 78 ° C je v pevném stavu a je známý jako suchý led, který dostal své jméno, protože svým vzhledem připomíná led. běžné, ale nerozpouští se, přechází do kapalného stavu při pokojové teplotě, ale přechází do stavu páry, tj. vznešené. Tato funkce se tedy používá jako scénický zdroj na koncertech, filmech, divadlech, večírcích atd.

Oxid uhličitý je oxid kyseliny
Vyskytuje se také v atmosféře v důsledku lidského dýchání, spalování fosilních paliv (uhlí, ropné produkty, alkohol atd.) A lesních požárů. Je tedy jedním z těch, kteří jsou zodpovědní za kyselé deště.
Nepřestávejte... Po reklamě je toho víc;)
• Oxidy síry - SO2 a SO3
Tyto oxidy jsou také přítomny v atmosféře a jsou přírodního a umělého původu. K přirozenému dochází prostřednictvím sopečných erupcí a rozkladu rostlin a živočichů. Umělá odpovídá největšímu množství těchto oxidů v atmosféře, jaké jsou vyloučen spalováním fosilních paliv, zejména motorové nafty, která obsahuje síru jako např nečistota.
Oxid siřičitý (SO2) reaguje s kyslíkem z atmosféry za vzniku oxidu sírového (SO3). Když tento poslední oxid reaguje s dešťovou vodou, vytváří se kyselina sírová, která je velmi silná a způsobuje poškození.
• Spalování síry z paliv: S + O2 → OS2
• Transformace SO2 na SO3: SO2 + ½2 → OS3
Reakce SO2 a SO3 s vodou za vzniku kyselin: SO2 + H2O → H2POUZE3
POUZE3 + H2O → H2POUZE4
• Dinitrogen tetroxidy (nitro-dusičná anhydrid) - N2Ó4
Tato sloučenina má teplotu varu 22 ° C, má žlutou barvu a je velmi těkavá. Vzniká v atmosféře oxidací dusíku a může být v kapalné formě, ve formě dimeru oxidu mononitrogenového nebo oxidu dusnatého (NO2). Nad touto teplotou nabývá podoby NO2:
N2Ó4 ↔ Č2
Je to extrémně toxický plyn a jeho vdechnutí je smrtelné. Používá se také ve složení raketových paliv.
Autor: Jennifer Fogaça
Vystudoval chemii

