Plyn a pára
Rozdíl mezi plynem a párou je dán kritickou teplotou. Pára je hmota v plynném stavu, ve stavu, který lze zkapalnit se zvyšujícím se tlakem. Plyn není stejný. Je to tekutina, kterou nelze zkapalnit pouhým zvýšením tlaku. Tím se plyn liší od páry.
Chování plynů
Daná látka v plynném stavu je plyn, pokud je jeho teplota vyšší než kritická teplota, pokud je teplota rovna nebo nižší než kritická teplota, kterou je látkou pára.
Skutečné plyny, které běžně známe, jako je helium, dusík a kyslík, mají u každého z nich odlišné a konkrétní molekulární charakteristiky. Pokud je však všechny vystavíme vysokým teplotám a nízkým tlakům, začnou vykazovat velmi podobné chování. Při studiu plynů je přijat jednoduchý teoretický model, který v praxi neexistuje, s chováním podobným chování skutečných plynů. Tato aproximace se zlepšuje, čím nižší je tlak a čím vyšší je teplota. Tento plynový model se nazývá perfektní plyn.
Kolem 17. a 19. století tři vědci (Jacques Charles, Louis J. Gay-Lussac a Paul E. Clayperon), po studiu chování plynů, vypracoval zákony upravující chování dokonalých plynů, nazývaných také ideální plyny. Zákony, které určují, stanoví pravidla „vnějšího“ chování dokonalého plynu, vedoucí k počítá pouze fyzické veličiny, které jsou s nimi spojeny, což jsou: objem, teplota a tlak.
Obecný zákon dokonalých plynů
Výraz, který určuje obecný zákon pro dokonalé plyny, lze vidět následovně:
Nepřestávejte... Po reklamě je toho víc;)
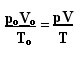
kde pÓ, VÓ a TÓ jsou počáteční tlak, počáteční objem a počáteční teplota. Toto je výraz, který se používá, když se proměnné plynu mění.
Boyleův zákon
Robert Boyle, fyzik a chemik, byl tím, kdo určil zákon, který řídí transformace, kterými plyn prochází, když je jeho teplota udržována konstantní. Jeho zákon říká, že když plyn prochází izotermickou transformací, je jeho tlak nepřímo úměrný obsazenému objemu. Z tohoto zákona získáváme, že jak TÓ = T Musíme:
PÓPROTIÓ = pV
Charlesův zákon
Charlesův zákon je zákon, který řídí transformace dokonalého plynu na konstantní objem. Tyto transformace se nazývají izochorické nebo izometrické transformace. Podle tohoto zákona, když dokonalá plynová hmota prochází izochorickou transformací, je její tlak přímo úměrný její absolutní teplotě. Matematicky lze tento zákon vyjádřit následovně:

kde pÓ a TÓ jsou počáteční tlak a počáteční teplota.
Zákon Gay-Lussac
Gay-Lussacův zákon je zákon, který řídí transformace dokonalého plynu při konstantním tlaku. Tento zákon, přestože nesl jméno Gay-Lussac, již objevil fyzik a chemik A.C. Charles. Podle zákona, když plyn prochází izobarickou transformací, je objem plynu přímo úměrný jeho absolutní teplotě. Matematicky lze tento zákon vyjádřit následovně:

Kde VÓ a TÓ odpovídá počátečnímu objemu a počáteční teplotě.
Autor: Marco Aurélio da Silva
Vidět víc!!
Plynové transformace
Zjistěte, co jsou transformace plynu.
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
SANTOS, Marco Aurélio da Silva. „Studium plynů“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Zpřístupněno 27. června 2021.