V laboratořích a chemickém průmyslu je velmi důležité znát množství látek zapojených do reakcí. Níže se proto budeme zabývat hlavními pojmy, veličinami a měrnými jednotkami týkajícími se hmotností atomů:
- Jednotka atomové hmotnosti (u):
Referenční atom standardní hmotnosti pro označení jednotky atomové hmotnosti je uhlík-12 (12C). Jednotka atomové hmotnosti (1 u) odpovídá hodnotě 1,66054. 10-24 g, což je hmotnost 1/12 izotopu uhlíku s hmotností rovnou 12 (12C).
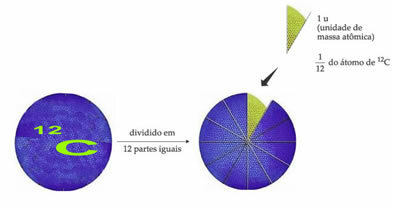
Jednotka atomové hmotnosti (u) je jednotka použitá ve všech níže uvedených množstvích.
- Atomová hmotnost atomu nebo izotopu (MA):
Získává se porovnáním s referenční hodnotou uvedenou v předchozí položce. Například atomová hmotnost 919F je dáno hmotnostním spektrometrem, který se rovná 18,9984 u. Zaokrouhlení nahoru se rovná 19, což je stejná hodnota jako jeho hromadné číslo (A). Tato hodnota znamená, že atomová hmotnost prvku 919F je 19krát větší než hmotnost 1/12 12C.
- Atomová hmotnost prvku (AM):
Atomová hmotnost prvku je určena váženým průměrem atomových hmotností jeho izotopů. To se provádí vynásobením atomových hmotností každého izotopu procentem, které se objeví v ústavě prvku. Tyto hodnoty jsou poté sečteny, které jsou vyděleny 100, což vede k celkovému procentu.
Nepřestávejte... Po reklamě je toho víc;)
Například prvek neon se skládá ze tří izotopů s následujícími atomovými hmotnostmi a procenty v jejich složení:

Výpočet atomové hmotnosti (MA) tohoto prvku:
ŠPATNÝneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
ŠPATNÝneon = 20 179 u
- Molekulová hmotnost (MM):
Jak název napovídá, používá se pro molekulární látky, tj. Atomy spojené sdílením párů elektronů, které se nazývají kovalentní vazby.
Molekulová hmotnost se získá vynásobením počtu atomů každého prvku jejich atomovými hmotnostmi a sečtením výsledků.
Například molekula CO2 obsahuje jeden uhlík a dva kyslíky, takže atomovou hmotnost uhlíku vynásobíme 1; a kyslík dvěma, přidáním později:
MMCO2 = (1. ŠPATNÝC) + (2. ŠPATNÝÓ)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Hmotnostní vzorec:
Je to stejný výpočet provedený pro molekulární hmotnost, ale pro iontové sloučeniny. V tomto případě je název jiný, protože nejsou seskupeny do molekul, ale do shluků iontů. Jelikož molekuly neexistují, zjevně nemá smysl hovořit o molekulové hmotnosti, ale důvody výpočtu jsou stejné.
Příklad:
NaCl
↓ ↓
23 +35,5 → Hmotnost vzorce = 58,5 u
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. "Masy atomů"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm. Zpřístupněno 28. června 2021.


