Allotropy je vlastnost, že určité chemické prvky musí tvořit různé jednoduché látky, tj. látky tvořené pouze jediným typem prvku.
Různé vytvořené látky se nazývají tvary nebo alotropické odrůdy nebo allotropes.
Tyto alotropy se mohou lišit ze dvou hlavních důvodů, kterými jsou:
1. Jeho tomicita: počet atomů, které tvoří molekulu;
2. Struktura: Uspořádání atomů v krystalové mřížce je pro každou alotropickou formu odlišné.
Síra (S) je prvek, který má nejširší škálu alotropních forem, včetně molekul S2, S.4, S.6a s8, které se liší počtem atomů v každé molekule. Všechny tyto allotropy síry lze nalézt na místech náchylných k sopečným výbuchům, mezi teplotami 444,6 ° C a 1 000 ° C. Nad 1000 ° C však S2 začíná disociovat na atomovou síru (S0).
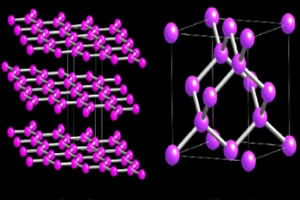
Nejdůležitějšími allotropy síry jsou však dva: o kosočtverečná síra to je monoklinická síra.
Oba jsou tvořeny stejným molekulárním vzorcem, s8, rozdíl mezi těmito dvěma je v prostorovém uspořádání atomů v krystalové mřížce.

Jak můžete vidět na obrázku níže, kosočtverečná síra je ve formě žlutých a průhledných krystalů, zatímco jednokliková je jehlovitá a neprůhledná:

Nepřestávejte... Po reklamě je toho víc;)
Mezi těmito dvěma alotropickými formami síry kosočtverec je nejběžnější. Má hustotu 2,07 g / cm3 při 20 ° C, bod tání 112,8 ° C a bod varu 444,6 ° C.
Monoklinika má hustotu 1,96 g / cm3 při 20 ° C, teplota tání rovná 119 ° C a stejná teplota varu jako kosočtverečná síra. Za podmínek prostředí jsou oba žlutý prášek, bez zápachu, nerozpustný ve vodě a velmi dobře rozpustný v sirníku uhlíku (CS2).

Síra má několik průmyslových využití, z nichž hlavní je výroba kyseliny sírové, H2POUZE4, který je zase široce používán při výrobě různých produktů. Vzhledem ke svému ekonomickému významu může spotřeba kyseliny sírové často indikovat stupeň rozvoje země.
Další důležitá aplikace síry je při vulkanizaci kaučuku, což je přidání 2 až 30% síry do kaučuku, za zahřátím a v přítomnosti katalyzátorů za vzniku trojrozměrného polymeru, přičemž síra slouží jako můstek mezi řetězci uhličitý. Díky tomu je přírodní kaučuk odolnější a pružnější, připravený pro různá použití, jako je výroba pneumatik.
Síra se také používá při výrobě černého prášku, insekticidů, kosmetiky a léčiv, jako jsou antibiotika na bázi sulfa.
* Redakční kredity za obrázek: emran / Shutterstock.com
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Alulfropy síry“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/alotropia-enxofre.htm. Zpřístupněno 28. června 2021.
Chemie
Co je alotropie, jednoduché látky, plynný kyslík, ozon, alotropní formy, chemický prvek kyslík, ultrafialové paprsky ze slunce, diamant, grafit, atomicita, bílý fosfor.


