Éter je to okysličená organická funkce, to znamená, že má kromě uhlíku a vodíku také chemický prvek kyslík. Tato funkce má jako hlavní strukturální charakteristiku přítomnost dvou organické radikály připojený k atomu kyslíku.
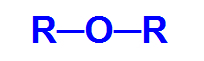
Obecný strukturní vzorec etheru
Uhlíkový řetězec etheru je tedy heterogenní a může mít dva stejné nebo různé radikály alkyl, typy radikálů, které nemají aromatickou strukturu, nebo aryl, radikály, které nemají strukturu aromatický.
Fyzikální vlastnosti etheru
Pokud jde o fyzikální stav při pokojové teplotě: když éter má ve svém složení čtyři nebo více atomů uhlíku, je kapalný;
Pokud jde o bod tání a bod varu: ve srovnání s jinými hromadnými organickými sloučeninami přibližně molární, mají teplotu tání podobnou jako u alkanů a nižší než zbytek sloučenin organický;
Pokud jde o hustotu: jsou to sloučeniny, které mají malou hustotu ve srovnání s vodou;
Pokud jde o interakční síly: ethery jsou složeny s nízkou polaritou a vzájemně na sebe působí prostřednictvím slabé trvalé dipólové interakce. S vodou a alkoholy mají ethery schopnost interagovat prostřednictvím vodíkových vazeb.
jako pro polarita: jsou sloučeniny, které mají úhlovou geometrii, takže jsou polární.
Pokud jde o organoleptické vlastnosti: jedná se o látky, které vydávají velmi příjemný zápach, ale jejich vdechování může způsobit závislost.
Oficiální nomenklatura etheru
Menší předpona stonku + oxy + hlavní předpona stonku + infix + o
Provádět oficiální nomenklaturu a éter, Je zásadní určit, který je váš hlavní ligand a který je váš vedlejší ligand. Postupujte podle níže uvedených dvou příkladů aplikace pro toto pravidlo pojmenování:
1. příklad:
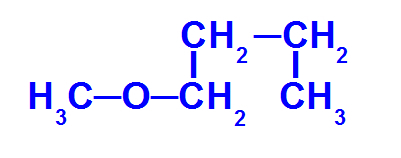
Strukturní vzorec etheru s menším počtem uhlíků
Ether výše má následující radikály:
Methyl (CH3-);
Butyl (CH3-CH2-CH2-CH2-).
K pojmenování této sloučeniny máme:
vedlejší radikální předpona: Met
+
kyslík
+
hlavní předpona kmene: ale
+
(protože má pouze jednotlivé odkazy)
+
Ó
Název toho éter bude to methoxybutan.
2. příklad:
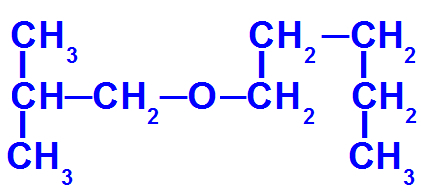
Strukturní vzorec etheru s více uhlíky
Tento ether má následující radikály:
Isobutyl [(CH3)2-CH-CH2-);
pentyl (CH3-CH2-CH2-CH2-CH2).
Abychom to pojmenovali, máme tedy:
menší radikální prefix: isobut
+
kyslík
+
hlavní radikální prefix: pent
+
(protože má pouze jednotlivé odkazy)
+
Ó
Tedy název éter dotyčný bude isobutoxypentan.
Obvyklá nomenklatura etheru
Ether + název radikálů (nejjednodušší a poté nejsložitější) + ico
nebo
Radikální jména + ether
Postupujte podle níže uvedených dvou příkladů aplikace pro toto pravidlo pojmenování:
1. příklad:

Strukturní vzorec etheru, který má čtyři uhlíky
Že éter představuje následující radikály:
Methyl (CH3);
Isopropyl (CH3-CH-CH3).
Takže pro tuto sloučeninu máme:
Éter
+
vedlejší radikál: Methyl
+
hlavní radikální předpona: isopropyl
+
ich
Tedy název éter jde o methylisopropylether, nebo také methylisopropylether.
2. příklad:

Strukturní vzorec etheru, který má pět uhlíků
Ether výše má následující radikály:
Ethyl (CH3-CH2-);
Propyl (CH3-CH2-CH2-).
K pojmenování této sloučeniny máme:
Éter
+
vedlejší radikál: ethyl
+
hlavní radikální předpona: propyl
+
ich
Tedy název éter jde o ethylpropylether, kterým může být také ethylpropylether.
Použití etherů
Obecně se používají ethery:
Jako inertní organická rozpouštědla, tj. Neúčastní se žádné reakce;
Používá se při extrakci esencí, jako jsou květiny, dřevo atd .;
Používá se při extrakci různých olejů a tuků.
Podle mě. Diogo Lopes
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eter.htm
