V textu „Magmatická elektrolýza”, Bylo vysvětleno, že k tomuto procesu dochází, když prochází elektrický proud v roztavené látce (v kapalném stavu), bez přítomnosti voda a tímto způsobem kation přijímá elektrony a anion elektrony, takže oba mají elektrický náboj rovný nule a energii nahromaděné.
Pro lepší pochopení toho, jak dochází k magné elektrolýze, zvažte jeden z nejdůležitějších příkladů tohoto typu procesu, elektrolýzu chloridu sodného nebo kuchyňské soli (NaCl).
Chlorid sodný se v přírodě tvoří přenosem elektronu ze sodíku (Na) na chlor (Cl), jak je uvedeno níže:
2Na (s) + 1Cl2(g) → 2NaCl (s)

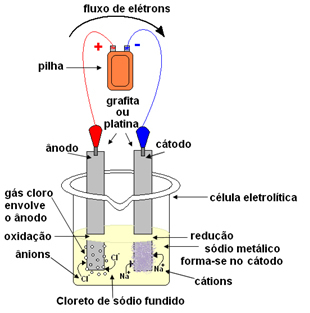
Tento proces je spontánní, ale inverzní proces této reakce není spontánní, tj. Produkce plynného chloru (Cl2(g) - obrázek níže) a kovový sodík (Na (s)) se v přírodě nevyskytuje. Chceme-li, aby se to stalo, budeme muset zahájit proces.
Toho lze dosáhnout magmatickou elektrolýzou. Sůl se zahřeje na teplotu nad 800,4 ° C, což je její teplota tání; a tímto způsobem se spojuje a přechází z pevné látky do kapalné. V tomto fyzickém stavu vaše ionty Na+ a Cl- jsou volní.
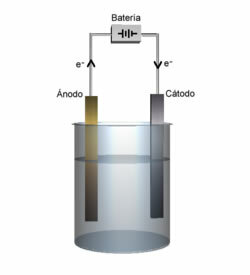
Roztavená sůl se poté umístí do nádoby, elektrolytické nádoby a dvě inertní platinové nebo grafitové elektrody se ponoří do chloridu sodného. Tyto elektrody jsou připojeny ke zdroji, který generuje stejnosměrný elektrický proud, jako je baterie nebo článek.
Při průchodu elektrického proudu dochází k následujícím:
- Záporný pól baterie nebo článku dodává elektrony jedné z elektrod, která se stává katodou;
- Katoda: přijímá elektrony z buňky a stává se záporným pólem, přitahuje kationty Na+, protože přitahují opačné poplatky. Tyto ionty přijímají elektrony z elektrody (katody) a dochází k jejich redukci za vzniku kovového sodíku:
Snížení:Na+(ℓ) + a- → V(s)
Kovový sodík je usazen na elektrodě a je odeslán do zásobníku.
Nepřestávejte... Po reklamě je toho víc;)
- Anoda: se stane kladně nabitým a přitahuje anionty Cl- (proto se tomu říká anoda). Tyto ionty ztrácejí své elektrony, když přicházejí do styku s anodou, a proto procházejí oxidací a vytvářejí atomy chloru, které se okamžitě spojují dva po druhém za vzniku plynného chloru:
Oxidace:2Cl-(ℓ) → 2 a- + 1Cl2(G)
Tento plyn bublá kolem anody a je shromažďován skleněnou trubicí přizpůsobenou systému.
Celková reakce, která v tomto případě nastane, je tedy dána vztahem:
Katoda: 2Na+(ℓ) + 2e- → 2Na(s)
Anoda: 2Cl-(ℓ) → 2 a- + 1Cl2(g) ____________
Globální reakce: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(G)
Dalším důležitým aspektem, který je třeba si uvědomit a který byl zdůrazněn na konci zmíněného textu (Igneous Electrolýza), je to, že pro elektrolýzu Dojde-li k tomu, že článek nebo baterie použitá ke generování elektrického proudu musí mít ddp (potenciální rozdíl) rovný nebo větší než potenciální rozdíl reakce.
Podívejme se na to v případě elektrolýzy chloridu sodného, kterou zvažujeme. Chcete-li zjistit potenciální rozdíl této reakce, stačí snížit standardní redukční potenciál katody o anodu. To je vysvětleno v textu. Potenciální rozdíl baterie .
Prostřednictvím tabulky standardních redukčních potenciálů (E.0červená), víme, že:
Na+(ℓ) + a- → V(s) A0červená = -2,71
2Cl-(ℓ) → 2 a- + 1Cl2g) AND0červená = +1,36
Nyní stačí snížit tyto hodnoty, abyste poznali potenciální rozdíl globální reakce:
„A0 = AND0červená (katoda) - A0červená (anoda)
„A0 = -2,71 – (+ 1,36)
„A0 = - 4,07 V
To tedy znamená, že článek nebo baterie, které budou použity, musí mít napětí rovné nebo větší než 4,07 V, aby bylo možné provést magmatickou elektrolýzu chloridu sodného.
Záporná hodnota pouze naznačuje, že se jedná o proces, který není spontánní.. V případě baterií, což je spontánní proces, je hodnota elektromotorické síly (∆E0) vždy dává pozitivní.
Autor: Jennifer Fogaça
Vystudoval chemii
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
FOGAÇA, Jennifer Rocha Vargas. „Elektrolýza chloridu sodného na sodík“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm. Zpřístupněno 28. června 2021.
e) Je to spontánní redoxní proces.
Chemie

Aplikace elektrolýzy, galvanického pokovování, niklování, chromování, niklu, chrómu, katody, sodíku, hliníku, chloru, louh sodný, plynný vodík, magnátní elektrolýza, vodná elektrolýza, alkalické kovy, kovy alkalických zemin, plyn chlór.
Chemie

Elektrolýza, roztoky elektrolytů, elektrický proud, oxidačně-redukční reakce, spontánní chemický proces, chemický proces spontánní, transformátor, umělá transformace, průmyslová odvětví, alkalické kovy, alkalické zeminy, plynný vodík, plyn tř