Vy aldehydy a ketony jsou to velmi podobné organické funkce. Oba mají ve své struktuře karbonylovou funkční skupinu (C = O), s jediným rozdílem, že v případě aldehydy, vždy se objeví na konci uhlíkového řetězce, to znamená, že jeden z karbonylových uhlíkových ligandů je vodík; ketony mají karbonyl mezi dvěma dalšími atomy uhlíku.
Aldehydy funkční skupina:Funkční skupina ketonů:
Ó Ó
║ ║
C C ─ H C C ─ C
Z tohoto důvodu existují případy funkčního izomerismu mezi aldehydy a ketony. Například níže uvádíme dva funkční izomery, které mají stejný molekulární vzorec (C3H6O), ale jeden je aldehyd (propanal) a druhý je keton (propanon). Podívejte se, jak to zcela mění jejich vlastnosti a aplikace:
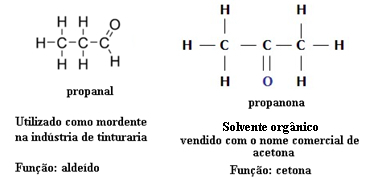
Příklad izomerismu funkce mezi aldehydem a ketonem
Představte si, že jste v laboratoři a najdete lahvičku s bezbarvou kapalinou, která má pouze molekulární vzorec C.3H6Ó. Co byste udělali, abyste zjistili, zda je to keton nebo aldehyd?
Chcete-li vyřešit takové problémy, existují způsoby diferenciace aldehydů a ketonů na základě reakce těchto sloučenin proti slabým oxidačním činidlům
. Jak je ukázáno níže, když čelí slabým oxidantům, aldehydy reagují oxidací, zatímco ketony nereagují. Říkáme toaldehydy působí jako redukční činidla, ale ketony ne, reagují pouze jako redukční činidla při kontaktu s energetickými oxidanty.Aldehydy + Slabá oxidační činidla → karboxylová kyselina
Ó
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Ketony + slabá oxidační činidla → Nereagujte
Ó
║
C ─ C ─ C + [O] → Nedojde k žádné reakci
Na základě toho stačí provést tuto reakci a zjistit, zda sloučenina reaguje nebo ne. Pokud reaguje, víme, že je to aldehyd; pokud nereaguje, je to keton.
Kromě toho jsou produkty vytvořené v těchto oxidačních reakcích aldehydu docela viditelné, přičemž dochází ke změnám barvy, jak bude ukázáno později.
Existují tři hlavní metody rozlišení aldehydů a ketonů, které jsou:
1 - Tollens Reaktivní: Toto činidlo je a amoniakální roztok dusičnanu stříbrného, tj. obsahuje dusičnan stříbrný (AgNO3) a přebytek hydroxidu amonného (NH4ACH):
AgNO3 + 3 NH4OH → Ag (NH3)ACH + NH4NA3 + 2 H2Ó
Tollens Reactive (pojmenovaný podle německého chemika Bernharda Tollensa (1841-1918))
Jak je vysvětleno v textu Výroba stříbrného zrcadla, když je aldehyd uveden do kontaktu s Tollens reaktivní, je oxidován na odpovídající karboxylovou kyselinu, zatímco ionty stříbra jsou redukovány na Ag0 (kovové stříbro). Pokud se tato reakce provádí například ve zkumavce, usazuje se toto kovové stříbro na stěnách zkumavky, což vede k vytvoření filmu zvaného stříbrné zrcadlo. Tento pozorovaný výsledek je velmi krásný a používá se v procesu výroby průmyslových zrcadel.
Reakce, která probíhá, lze vyjádřit následovně:
Ó
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Ag+ + 2e- → 2 Ag0
2 NH3 + 2 H+ → 2 NH4+
Ó Ó
║║
R C ─ H + 2 Ag+ + 2 NH3 + H2Ó → R C ─ OH + 2 Ag0 + 2 NH4+
aldehyd Tollens reaktivníkarboxylová kyselina kovové stříbro (stříbrné zrcadlo)
Na druhou stranu, pokud necháme keton reagovat s Tollensovým činidlem, nedojde k tvorbě kovového stříbra, protože ketony nemohou redukovat ionty Ag.+.
2 - Fehling Reaktivní: Tato reaktivní je modrý roztok síranu měďnatého II (CuSO4) v bazickém prostředí, protože se smísí s dalším roztokem vytvořeným hydroxidem sodným (NaOH) a vínanem sodným a draselným (NaOOC-CHOH-CHOH-COOK). K roztoku síranu měďnatého II se přidá vinan, aby se stabilizoval a zabránilo se jeho srážení.
KUSO4 + 2 NaOH → Na2POUZE4 + Cu (OH)2
Fehling Reactive (pojmenovaný podle německého chemika Hermanna von Fehlinga (1812-1885))
Při kontaktu s Fehlingovou reaktivní aldehyd tvoří oxidací karboxylovou kyselinu, zatímco ionty mědi (Cu)2+) přítomné ve středu jsou redukovány a vytvářejí červenohnědou sraženinu (více jako cihla), kterou je oxid měďný. Ketony na druhou stranu nereagují - protože nemohou redukovat ionty Cu2+.
Ó
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Osel2Ó + 2 H2Ó
aldehyd červenohnědá sraženina
3- Benediktův reaktivní: Tato reaktivní látka je také tvořena roztokem síranu měďnatého II (Cu (OH)2) v základním médiu, ale smíchá se s citrátem sodným.
Stejně jako u Fehlingova činidla existují i v případě reakce mezi aldehydem a Benediktovým činidlem ionty mědi (Cu2+) přítomné v médiu, které jsou redukovány a tvoří červený oxid měďný.
Toto činidlo je široce používáno v testech k detekci přítomnosti a obsahu glukózy v moči. Glukóza má ve své struktuře aldehydovou skupinu, takže pro tyto testy reaguje s Benediktovým činidlem přítomným v pásech. Odtud stačí porovnat barvu pásky s barvou stupnice na obalu produktu.

Benediktovo činidlo se používá ke stanovení obsahu glukózy v moči.
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm
