تسمى عناصر الأسرة 17 أو VII A من الجدول الدوري الهالوجينات ، ممثلة بالعناصر الخمسة المدرجة أدناه: الفلور (F) والكلور (Cl) والبروم (Br) واليود (I) والأستاتين (At). غالبًا ما يتم تمثيلهم بشكل عام بالحرف X.

أهمها ، بسبب استخداماتها اليومية ، الكلور والبروم واليود.
هذا الاسم "الهالوجين" يعني "تكوين الملح".
كل منهم لديه 7 إلكترونات في غلاف التكافؤ (الغلاف الإلكتروني الأبعد عن النواة وأكثر نشاطًا). بشكل عام: ns2 np5. ونتيجة لذلك ، فإنهم يميلون إلى تلقي إلكترون وتشكيل أيونات أحادية التكافؤ سالبة (X-1) ، يتفاعل بشكل أساسي مع الفلزات القلوية (الأسرة 1 الفلزات) ، والتي تميل إلى التبرع بإلكترون. وبالتالي ، فإنها تؤدي إلى ظهور مركبات بها صيغ من نوع MX.

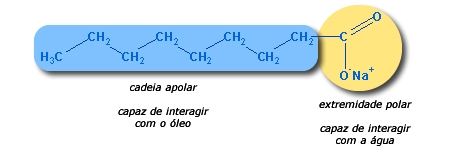
من خلال اكتساب هذا الإلكترون ، تكون الهالوجينات مستقرة ، حيث تكتمل غلاف التكافؤ (بثمانية إلكترونات) وتتغير خصائصها تمامًا. على سبيل المثال ، غاز الكلور (Cl2) هو غاز أصفر مخضر ، كثيف ، شديد السمية والتفاعل ، قابل للذوبان في الماء بشكل ضئيل ويتفاعل مع الهيدروجين بشكل متفجر. ومع ذلك ، عندما الكلور (Cl) يتلقى إلكترونًا من الصوديوم (Na) ، يصبح أيونات ، مكونًا كلوريد الصوديوم (NaCl) ، أو ملح الطعام ، والذي نتناوله يوميًا وهو ضروري للحفاظ على حياتنا. يتحول الكلور بشكل خاص إلى أيون الكلوريد (Cl
-) وهو ضروري في أجسامنا لتكوين حمض الهيدروكلوريك (HCl) ، وهو المكون الرئيسي لعصير المعدة لدينا.في الواقع ، الكلور هو الأكثر وفرة من الهالوجينات ويستخدم في إنتاج المركبات العضوية ، غير العضوية ، في صناعة الورق (تهدف إلى تبييض اللب) وفي الماء و المجاري. من الشائع أيضًا استخدام محلول مائي من هيبوكلوريت الصوديوم (NaClO) ، والذي يسمى "الكلور السائل" والذي يوجد في تركيبة التبييض.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
حقيقة مثيرة للاهتمام هي أنه على الرغم من أن بعض الناس يقولون أن "الكلور الصلب" يستخدم في حمامات السباحة ، فإنه في الواقع ليس عنصر الكلور فقط ، بل هوبوكلوريت الكالسيوم (Ca (ClO)2).
أيضا ، حالة مماثلة هي استخدام الفلور - وهو في الواقع ليس الفلور في حد ذاته ، ولكن الفلورايد (المركبات الأيونية التي تحتوي على عنصر الفلور) - في معالجة مياه الشرب ومنتجات العناية بالفم.
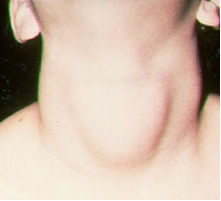
فيما يتعلق اليودمن التطبيقات المهمة إضافتها (في شكل يوديد أو يودات الصوديوم والبوتاسيوم) ، التي يقتضيها القانون ، إلى ملح الطعام. وذلك لأن نقص اليود في الجسم يمكن أن يسبب مرضًا يسمى تضخم الغدة الدرقية ، المعروف باسم بابو.
ا البروم إنه سائل أحمر ، في درجة حرارة الغرفة ، كثيف وغير مستقر ، ولأنه متطاير ، يمكن أن يتبخر مكونًا بخارًا ضارب إلى الحمرة. لا توجد في الطبيعة بمعزل عن غيرها ، ولا تستخدم في الصناعة بهذه الطريقة. التطبيقات الرئيسية لمركباته هي: كمحفزات للتفاعلات العضوية ، مختلطة بالوقود ، في التطورات الفوتوغرافية ، من بين أمور أخرى.
بالفعل أستاتين إنه عنصر مشع. عادة ما يكون مصدره نتيجة الاضمحلال الإشعاعي لليورانيوم ونظائر الثوريوم. إنه يشكل 20 نظيرًا على الأقل ، مع كون At-210 هو الأكثر استقرارًا ، مع عمر نصف يبلغ 8.3 ساعات. إنه عنصر نادر جدًا.
بقلم جينيفر فوغاسا
تخرج في الكيمياء