تحدث الهدرجة مع الهيدروكربونات غير الحلقية غير المشبعة ، أي التي لها سلاسل مفتوحة ذات روابط مزدوجة أو ثلاثية ، مثل الألكينات والألكينات والدينات. يمكن أن يحدث أيضًا في الهيدروكربونات العطرية ، حيث تحتوي على روابط مزدوجة في الحلقة ، ومع السيكلان (الألكانات الحلقيّة) تصل إلى خمسة ذرات كربون.
تتفاعل هذه المركبات مثل غاز الهيدروجين في وجود بعض المحفزات ، مثل النيكل والبلاتين والبلاديوم ، تحت التسخين. وبالتالي ، يحدث تفاعل إضافة ، حيث يتم كسر رابطة pi (π) ، وتشكيل رابطتين منفردتين جديدتين ويتم إدخال الهيدروجين إلى الجزيء.
بشكل عام ، لدينا:
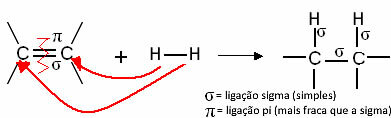
تفاعل الهدرجة العام
الآن دعنا نلقي نظرة على بعض الأمثلة:
- الهدرجة للألكينات: المنتج الذي تم الحصول عليه هو ألكان.
يوجد أدناه تفاعل هدرجة للإيثيلين (أو الإيثيلين) للحصول على الإيثان:
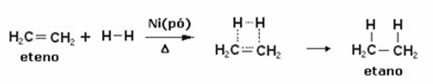
مثال على تفاعل هدرجة الإيثيلين
يستخدم هذا النوع من الهدرجة التحفيزية في صناعة المواد الغذائية لصنع دهون شبه صلبة مثل المارجرين. تختلف الزيوت والدهون النباتية فقط في أن الزيوت لها جزيئات طويلة مع روابط مزدوجة بين الكربون ، في حين أن الدهون لها روابط واحدة فقط بينها الكربون.
وبالتالي ، لتحويل الزيت إلى دهون ، يكفي هدرجة الزيت. بهذه الطريقة سيتم كسر روابطك المزدوجة وتحويلها إلى سندات فردية. والنتيجة هي إنتاج المكالمات
دهون نباتية مهدرجة.- هدرجة ألكين: نظرًا لأن الألكينات لها رابطان pi ، فإن الهدرجة الكاملة تحدث على مرحلتين ، في الأولى يتم تشكيل ألكين وفي الثانية ، ألكان.
في التفاعل أدناه ، لدينا هدرجة البروبين مع التكوين النهائي للبروبان:
الخطوة الأولى: ح3نسخة ≡ CH + ح2 → H.3نسخةح═ جح2
المرحلة الثانية: ح3نسخةح═ جح2 + ساعاتين2 → H.3نسخةح2─ جح3
إذا أردنا أن يتوقف هذا التفاعل في الخطوة الأولى ، يجب أن نستخدم بعض المواد التي تقاطع عمل المحفز.
- هدرجة الديانات: هناك ثلاثة أنواع من الديانات: المتراكمة (تظهر الروابط المزدوجة أدناه) ، معزول (يتم فصل الروابط المزدوجة بواسطة سندات واحدة على الأقل) و يقارن (تظهر الروابط المزدوجة بالتناوب).
تحدث هدرجة الديينات المتراكمة والمعزولة بنفس الطريقة التي رأيناها للألكينات ، ولكن بشكل مضاعف ، حيث أن الديينات لديها عدم تشبع أكثر. شاهد مثالين:
* مثال على الهدرجة في الدين المتراكم:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
H H H
│ │ │
ح3C CH ═ ج ═ CH CH3 + ساعاتين2 → H.3C CH ─ ج ─ CH CH3
│ │ │
H H H
* مثال على الهدرجة في ديين معزول:
H H H H
│ │ │ │
ح3C CH ═ تشوش2 CH ═ CH CH3 +2 ح2 → H.3C CH ─ تشوش2 CH ─ CH CH3
من ناحية أخرى ، يمكن أن تحدث هدرجة الديانات المترافقة بطريقتين: مع إضافة 1.2 وإضافة 1.4. الأكثر شيوعًا هو الإضافة 1،2 ، حيث يتم إضافة الهيدروجين إلى الكربون الذي يصنع الرابطة المزدوجة وفي درجات حرارة منخفضة. من ناحية أخرى ، تحدث إضافة 1.4 في درجات حرارة مرتفعة وعندما يكون هناك صدى وظهور التكافؤات الحرة في الكربون 1 و 4. شاهد أمثلة على كل حالة:
* مثال على إضافة 1.2 في الديانات المترافقة:
ح2C CH ─ CH ═ CH2 + ح2 → H.2C CH ─ C ─ CH CH2
│ │
ح ح
* مثال على إضافة 1.4 في الديانات المترافقة:
ح2C CH ─ CH ═ CH2 + ح2 → H.2C CH ═ CH CH2
│ │
ح ح
- هدرجة المواد العطرية: يتم كسر روابط pi في حلقة البنزين وتضاف ذرات الهيدروجين إلى الكربون الذي يصنع هذه الروابط.
يظهر هذا النوع من الهدرجة الكلية أدناه:

تفاعل الهدرجة الكلي للبنزين
- هدرجة السيكلان: يحدث تكوين ألكان.
مثال: هدرجة البروبان الحلقي:
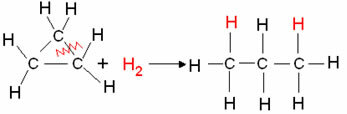
تفاعل هدرجة السيكلوبروبان
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تفاعل الهدرجة العضوي" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm. تم الوصول إليه في 28 يونيو 2021.
الفضول

كيف نشأت المارجرين ؟، المارجرين ، تاريخ ظهور المارجرين ، الجائزة التي فاز بها هيبوليت دي ميغي موريس في عام 1869 ، جائزة اقترحتها حكومة نابليون ، في وقت كانت فيه فرنسا تمر بأزمة اقتصادية خطيرة ، تعرضات عديدة