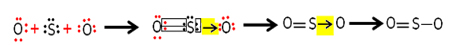
عبارة مستخدمة على نطاق واسع ومعروفة حول قانون لافوازييه هو الذي يقول:
“في الطبيعة ، لا يضيع شيء ، ولا يتم إنشاء شيء ، ويتحول كل شيء "
في الواقع ، لم يقترح الكيميائي الفرنسي أنطوان لافوازييه هذه العبارة ، بل اقترحها الفيلسوف اليوناني لوكريتيوس في القرن الأول قبل الميلاد. تنسب هذه العبارة إلى لافوازييه لأن عمل هذا العالم الذي أدى إلى كتابة أطروحة أولية في الكيمياء ، في عام 1774 ، يتكون من إجراء العديد من التجارب في الأنظمة المغلقة التي أثبتت الحفاظ على الكتلة في الأنظمة. مواد كيميائية.
خلال دراسته ، لاحظ لافوازييه أنه عند معالجة تفاعل كيميائي في نظام مغلق ، كتلة مواد التفاعل المتفاعلة تساوي تمامًا كتلة المواد الجديدة المتكونة في نهاية تفاعل. وهكذا ، فإن المشهور قانون الوزن، يسمى قانون لافوازييه والذي ينص على:
“مجموع كتل المواد المتفاعلة في تفاعل كيميائي يساوي مجموع كتل المنتجات "
الكاشف 1 كتلة المنتج 1 الكتلة
+ = +
الكاشف 2 كتلة المنتج 2 الكتلة
بغض النظر عما إذا كان التفاعل يحدث في نظام مفتوح أو مغلق ، يتم ملاحظة قانون لافوازييه طوال العملية الكيميائية.
كلما تطورنا الحسابات من خلال قانون لافوازييه ،
نرى أن صيانة شاملة النظام قبل وبعد التفاعل يكون ثابتًا. تخضع الذرات الموجودة في الكواشف لإعادة تنظيم فقط ، وتشكيل مواد جديدة (منتجات).أنت الحسابات التي تنطوي على قانون لافوازييه تشير إلى الكتلة التي سيتم إنتاجها في المنتجات وكذلك كتلة أي من المشاركين في التفاعل. انظر بعض الأمثلة:
(UFGD) التحول الكيميائي:
2KI(س) + الرصاص (NO3)2 → 2KNO3 (ق) + PbI2 (ق)
أبيض أبيض أبيض أصفر
هو مثال على تفاعل بين المواد الصلبة يحدث بسرعة. في وعاء زجاجي بغطاء ، بوزن 20 جم ، تم وضع 2 جم من KI و 4 جم من Pb (NO).3)2، رش. تم اهتزاز الحاوية ، المغلقة بإحكام ، بقوة لحدوث التفاعل. ما الكتلة الكلية للوعاء في نهاية التفاعل؟
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
البيانات التي يوفرها التمرين:
كتلة كاشف KI = 2 جرام ؛
كتلة كاشف الرصاص (NO3)2 = 2 جرام
كتلة الحاوية التي يحدث فيها التفاعل = 20 جرامًا.
نظرًا لأن كتلة المنتجات تساوي كتلة المواد المتفاعلة ، إذا كان لدينا 6 جرامات من المواد المتفاعلة (2 + 4) ، فسنحصل على تشكيل 6 جرام من المنتجات بعد التفاعل ، لأن الذرات الموجودة في المنتجات هي نفسها في الكواشف.
ستكون الكتلة الإجمالية للحاوية هي مجموع كتلة المنتجات (التي تساوي كتلة المواد المتفاعلة) وكتلة الحاوية.
2 + 4 + 20 = 26 جرام
(UFGD) يتم تمثيل تحول الأوزون إلى أكسجين شائع بالمعادلة: 2O3 → 3O2. عندما يتم تحويل 96 جرامًا من الأوزون تمامًا ، فإن كتلة الأكسجين العادي المنتجة تساوي: المعطى: O = 16u
أ) 32 جم ب) 48 جم ج) 64 جم د) 80 جم هـ) 96 جم
وفقًا لقانون لافوازييه ، فإن مجموع كتل المواد المتفاعلة يساوي مجموع كتل المنتجات. إذا كان لدينا 96 جرامًا من الأوزون ، فإن كتلة الأكسجين الناتجة ستساوي بالضرورة 96 جرامًا.
(UNIFIED-RJ) وفقًا لقانون لافوازييه ، عندما نتفاعل بشكل كامل ، في بيئة ما مغلق ، 1.12 جم من الحديد مع 0.64 جم من الكبريت ، الكتلة بالجرام من كبريتيد الحديد المتحصل عليها ستكون: البيانات: S = 32 ؛ Fe = 56
Fe + S → FeS
أ) 2.76 ب) 2.24 ج) 1.76 د) 1.28 هـ) 0.48
البيانات التي قدمها التمرين هي:
كتلة كاشف الحديد = 1.12 جرام ؛
كتلة كاشف الكبريت = 0.64 جرام.
عند حساب كتلة FeS ، وهي المنتج الوحيد ، وفقًا لقانون لافوازييه ، علينا:
مجموع كتل المواد المتفاعلة = مجموع كتل المنتجات
1.12 + 0.64 = س
س = 1.76 جرام
بي ديوغو لوبيز دياس