العنصر الكيميائي الفوسفور (P) ينتمي إلى الفترة الثالثة من الجدول الدوري وعائلة النيتروجين (VA). لهذا السبب ، تتكون ذراتها عادة من ثلاث ذرات روابط كيميائية للوصول إلى نظرية الثماني (المزيد). ومع ذلك ، هناك بعض المواقف التي تصنع فيها ذرة الفوسفور أكثر من ثلاث روابط ، وهي حقيقة لا يمكن تحقيقها إلا من خلال ظاهرة التهجين.
لفهم تهجين الفوسفور ، يجب أن نفهم أولاً سبب تكوين ذرة هذا العنصر لثلاثة روابط. للقيام بذلك ، نحتاج فقط إلى مراقبة التوزيع الإلكتروني الخاص بك:

توزيع الفوسفور الإلكتروني
يمكننا أن نلاحظ أنه في طبقة التكافؤ ، تحتوي ذرة الفوسفور على المستوى الفرعي 3s الكامل (مع إلكترونين) والمستوى الفرعي 3p غير المكتمل (كل من المدارات الثلاثة ذات المستوى الفرعي p لها إلكترون). أدناه لدينا توزيع الإلكترونات في مدارات المستويات الفرعية لـ طبقة التكافؤ الفوسفور:
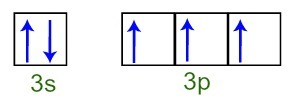
تمثيل إلكترونات غلاف التكافؤ لذرة الفوسفور
نظرًا لأن كل من المدارات ذات المستوى الفرعي 3p غير مكتملة ، فإن ذرة الفوسفور قادرة على تكوين ثلاث روابط كيميائية ، وبالتالي تحقيق الاستقرار.
الآن عندما ننظر إلى مادة PCl5، على سبيل المثال ، نحن على يقين من أن الفوسفور في هذا الجزيء قد خضع لعملية تهجين ، حيث قام بعمل خمسة اتصالات. نظرًا لأن الكلور ، الذي ينتمي إلى عائلة VIIA ، يحتاج إلى رابطة ليكون مستقرًا ويحتوي الجزيء على خمس ذرات من هذا عنصر ، كل منهم يجب أن يصنع رابطة ، مما يجعل ذرة الفوسفور ، بدورها ، يجب أن تصنع خمسة روابط. هذا التواجد ممكن فقط من خلال
تهجين (اتحاد مدارات ذرية غير مكتملة) من الفوسفور.لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
عند تلقي الطاقة من البيئة الخارجية ، تصبح إلكترونات ذرة الفوسفور متحمسة. بعد فترة وجيزة ، ينتقل أحد الإلكترونين المنتمين إلى المستوى الفرعي 3s إلى مدار فارغ موجود في المستوى الفرعي d ، والذي حتى ذلك الحين لا يحتوي على أي إلكترونات. انظر الرسم البياني أدناه:
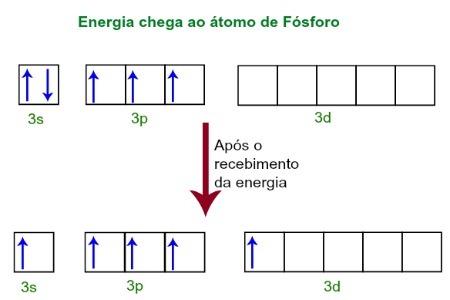
عند تلقي الطاقة ، يتم إثارة إلكترونات الفوسفور ويحتل المرء مدارًا من المستوى الفرعي d.
في هذه اللحظة ، لدينا في طبقة التكافؤ للفوسفور مداري s وثلاثة مدارات p ومدار d غير مكتمل.في النهاية ، تهجين هذه المدارات الخمسة ، أي تندمج ، مما ينتج عنه خمسة مدارات ذرية غير كاملة ، والتي أصبحت الآن قادرة على تكوين خمس روابط كيميائية.

تهجين المدارات الذرية غير المكتملة للفوسفور
كمدار s ، تم ربط ثلاثة مدارات p ومدار d ، يكون تهجين الفوسفور من النوع ص3د.
بي ديوغو لوبيز دياس
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
DAYS ، ديوغو لوبيز. "تهجين الفوسفور" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. تم الوصول إليه في 28 يونيو 2021.