الكيميائي الأمريكي جيلبرت ن. اقترح لويس (1875-1946) قاعدة الثمانيات التي تقول:
"تُنشئ ذرات العناصر المختلفة روابط كيميائية ، وتتبرع بالإلكترونات أو تستقبلها أو تتقاسمها ، من أجل الحصول على التكوين الإلكتروني لـ غاز نبيل ، أي يحتوي على 8 إلكترونات في الغلاف الأخير (أو مع إلكترونين في حالة تلك الذرات التي تحتوي على غلاف إلكترون واحد فقط ، كما يحدث مع هيدروجين)."
في عام 1916 ، اقترح لويس أن تظل العناصر المكونة لـ المواد الجزيئية إجراء تقاسم أزواج من الإلكترونات. تتكون هذه المواد فقط من ذرات الهيدروجين وغير الفلزات وشبه المعادن، كل ذلك بامتداد الميل لاستقبال الإلكترونات. لذلك ، لا توجد طريقة لأي منهم للتبرع بأي إلكترون (كما يحدث مع المعادن في الروابط الأيونية) ، ولكن يحتاج الجميع إلى تلقيها ، لذلك يشاركون إلكتروناتهم من خلال رابطة تساهمية أو جزيئي.
وهكذا ، اقترح جيلبرت لويس طريقة لتمثيل الرابطة التساهمية أو الجزيئية ، والتي أصبحت تُعرف باسم صيغة لويس. انها تسمى ايضا صيغة إلكترونية أو حتى الآن صيغة لويس الإلكترونية، لأن ما يميزه هو أنه يُظهر الإلكترونات في غلاف التكافؤ لكل ذرة وتشكيل أزواج إلكترونية.
يتم تمثيل كل إلكترون بنقطة.، الذي يحيط برمز العنصر الكيميائي المقابل. توجد إلكترونات غلاف التكافؤ فقط حول العنصر.
كما هو موضح في الجدول أدناه ، لمعرفة كمية الإلكترونات في غلاف التكافؤ ، فقط تعرف على عائلة الجدول الدوري:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)

في صيغة لويس ، يمثل كل زوج إلكترون مشترك رابطة كيميائية (تساهمية), حيث تلتقي الإلكترونات في منطقة الغلاف الكهربائي المشتركة لكل زوج من الذرات التي ترتبط ببعضها البعض. لذلك ، في التمثيل ، يتم وضعهم جنبًا إلى جنب.
على سبيل المثال ، دعنا نتعرف على صيغة لويس لغاز الهيدروجين ، الذي صيغته الجزيئية: H2.
تحتوي كل ذرة هيدروجين على إلكترون واحد فقط في غلاف التكافؤ ، حيث ينتمي هذا العنصر إلى العائلة 1 من الجدول الدوري. يحتاج كل منهم إلى تلقي إلكترون آخر ، ليكون مستقرًا ، مع إلكترونين في غلاف الإلكترون K. لذلك يتشاركون إلكتروناتهم ويحصل كلاهما على اثنين. نظرة:
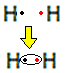
هذه هي صيغة لويس لجزيء غاز الهيدروجين.
يحتوي الأكسجين على ستة إلكترونات في غلافه الإلكتروني ، لذلك يحتاج كل منها إلى تلقي إلكترونين آخرين ليكون مستقرًا ، مع ثمانية إلكترونات. لذلك ، فإن صيغة لويس لجزيء غاز الأكسجين هي:

تأكد من وجود رابطين ، حيث يوجد زوجان مشتركان.
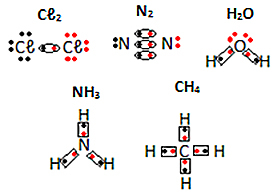
شاهد أمثلة أخرى للصيغ الإلكترونية للمواد الجزيئية أدناه:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "صيغة لويس الإلكترونية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. تم الوصول إليه في 28 يونيو 2021.
صيغة الكربون المكانية ، صيغة لويس الإلكترونية ، هيكل الطائرة ، الأزواج الإلكترونية ، السندات التساهمية ، طبقة التكافؤ ، تطور النموذج الذري ، الصيغة الجزيئية ، الصيغة التركيبية ، الصيغ ثلاثي الأبعاد.
الصيغ الكيميائية ، الصيغة الهيكلية المسطحة ، الصيغة الهيكلية كوبر ، الرابطة الثلاثية ، الغاز النيتروجين ، الصيغة الإلكترونية ، صيغة لويس ، الصيغة الجزيئية ، الرابطة الأحادية ، الرابطة المزدوجة ، الغاز فحمي.
كيمياء
المواد الجزيئية ، درجة حرارة الغليان ، سطح التلامس ، نقطة الغليان ، قوى الجذب بين الجزيئات ، الرابطة الكيميائية ، والمركبات الجزيئية ، والروابط الكيميائية التساهمية ، والروابط الأيونية ، والروابط المعدنية ، والحالات الفيزيائية لـ سيئ

