الغالبية العظمى من المواد الموجودة في الطبيعة وفي مجتمعنا وفي أجسادنا ليست مواد نقية ، ولكن في الواقع ، مخاليط من اثنين أو أكثر مواد.
على الرغم من أننا نشير في معظم الأحيان إلى المياه المعدنية فقط باسم "الماء" ، إلا أنها في الواقع لا تحتوي فقط على المادة النقية H2O ، لأنها نتيجة لعملية تخترق فيها مياه الأمطار التربة وتمر عبر الصخور المختلفة.
لذلك ، كما يوحي اسمه ، بالإضافة إلى الماء ، فإنه يحتوي أيضًا على العديد من المعادن المذابة. إذا كنت مهتمًا بالتحقق من ملصق أي مياه معدنية ، فسترى أنها تحتوي على مكوناتها كيمياء كبريتات السترونتيوم ، الكالسيوم ، الصوديوم ، البوتاسيوم ، بيكربونات الصوديوم ، فلوريد الصوديوم ، من بين الآخرين.
الخريطة الذهنية: الخلطات
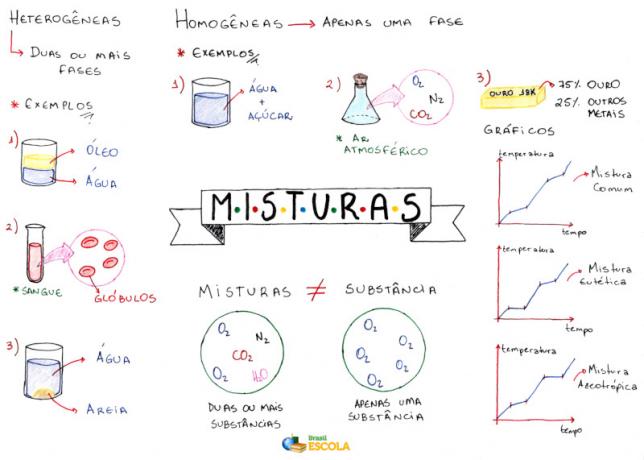
* لتنزيل الخريطة الذهنية بصيغة PDF ، انقر هنا!
كيف يمكن التفريق بين مادة من خليط؟
الماء المقطر الموضح أدناه عبارة عن مادة نقية تحتوي على H فقط2س:

الماء المقطر المستخدم في المختبر
بصريا ، يبدو تماما مثل خليط من الماء والملح. ومع ذلك ، يمكن تمييزها عن تعريف المزيج. نظرة:
→ الخلطات هي مواد لا تكون خصائصها الفيزيائية ثابتة ، ولكنها تختلف عند درجة حرارة وضغط معينين.
لذا ، فقط قم بقياس الخصائص الفيزيائية، مثل درجة الانصهار والغليان والكثافة. إذا كانت ثابتة ومحددة جيدًا ، فستكون أ مادة نقية (في حالة الماء المقطر ، عند 4 درجات مئوية ، تكون كثافته 1.0 جم / سم3 وعند مستوى سطح البحر ، تكون نقاط الانصهار والغليان 0 درجة مئوية و 100 درجة مئوية على التوالي).
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
ومع ذلك ، إذا تم تقديم الاختلافات ، فهي خليط. إذا قمت بتسخين خليط الماء والملح للتحقق من درجة الغليان ، فسترى ذلك أثناء التغيير من الحالة السائلة إلى الغاز ، لا تبقى درجة الحرارة ثابتة ، كما هو الحال مع الماء المقطر ، الذي يبقى عند 100 درجة مئوية حتى يتحول كل السائل بخار.
الآن يوجد مخاليط أنه ليس من الضروري تحديد خواصها الفيزيائية لمعرفة أنها مخاليط ، فقط انظر ، كما هو الحال مع الخليط التالي من الماء والزيت:

خليط يتكون من الماء والزيت
يشير هذا إلى وجود أنواع مختلفة من المخاليط التي يمكن تصنيفها إلى متجانسة وغير متجانسة. انظر كل واحد:
مخاليط متجانسة:
هم الذين لديهم مظهر موحد ، مع مرحلة واحدة (على مرحلة واحدة). أمثلة:
محلول ملحي (0.9 جم من كلوريد الصوديوم في 100 مل من الماء) ؛
محلول ملحي (36 جم من الأملاح مثل كلوريد الصوديوم وكلوريد المغنيسيوم ويودات البوتاسيوم ومضادات الرطوبة و 100 مل من الماء) ؛
الكحول المائي (الإيثانول والماء) ؛
الهواء (78٪ غاز نيتروجين ، 20٪ غاز أكسجين ، 2٪ غازات أخرى وبخار الماء) ؛
الصلب (سبيكة معدنية مكونة من 98.5٪ حديد و 1.5٪ كربون).

المالحة والصلب والفورمالديهايد ، أمثلة على الخلائط المتجانسة
الأمثلة أعلاه تظهر ذلك مخاليط متجانسة يمكن أن تكون في حالة صلبة أو سائلة أو غازية. تسمى هذه المخاليط المتجانسة حلول ولا يمكن فصلها بالطرق الفيزيائية ، ولكن فقط بالطرق الكيميائية. لفصل الكحول عن الماء ، على سبيل المثال ، من الضروري إجراء عملية التقطير، لأن أ جهاز الطرد المركزي أو الترشيح لن تفعل.
بالإضافة إلى ذلك ، من المهم التأكيد على أنها يجب أن تكون كذلك متجانس حتى عند النظر تحت المجهر الفائق. بالعين المجردة ، قد يبدو الحليب والدم ، على سبيل المثال ، متجانسين ، ولكن تحت المجهر الفائق ، نرى أنهما في الواقع غير متجانسة. شاهد صورة الدم تحت المجهر ومراحلها المنفصلة بعد وضعها في جهاز نابذة فائق:
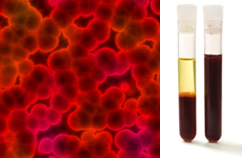
الصورة الميكروسكوبية ومراحل الدم
مخاليط غير متجانسة:
هي تلك التي لديها أكثر من مرحلة واحدة. أمثلة: الماء والزيت ، الماء والرمل ، الثلج والماء ، الجرانيت ، الماء والحديد ، الملح غير المذاب في الماء ، إلخ.
مكونات مخاليط غير متجانسة تظهر ، في معظم الحالات ، في حالات مادية مختلفة ويمكن فصلها بطرق فيزيائية. مثال على ذلك عندما نصنع القهوة ونرشح المادة الصلبة ، ونفصلها عن السائل.
لكن هذا لا يحدث دائمًا ، كما هو موضح في حالة الزيت والماء ، اللذين ، على الرغم من كونهما سائلين ، لا يذوبان بسبب الاختلاف. استقطاب جزيئاته.
الخريطة الذهنية بقلم الأم فيكتور ريكاردو فيريرا
مدرس كيمياء
بقلم جينيفر فوغاسا
تخرج في الكيمياء