ال جسر الملح اقترحه الكيميائي الإنجليزي فريدريك دانييل ، في عام 1836 ، عندما أنشأ هذا العالم البطارية سميت من بعده (Danill's Pile). هذا الجسر هو أنبوب على شكل حرف U له طرفان مساميان. (يتكون من قطن أو أجار أجار) ويحتوي على محلول مائي يتكون من الماء والملح. يربط بشكل غير مباشر محاليل خليتين نصفيتين للخلية (الأنود والكاثود).
ملاحظة: القطب الموجب هو القطب السالب للبطارية وهو مكان حدوث الأكسدة ، والكاثود هو القطب الموجب وحيث يحدث الاختزال.
لفهم أهمية جسر الملح ، من الضروري في البداية فهم طريقة عمل الكومة. انظر الرسم البياني أدناه:
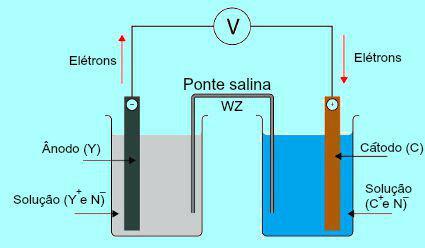
المخطط العام لمكدس دانييل
في البداية ، المعدن (Y) للوحة الموجودة في الأنود يخضع للأكسدة. عند التعرض للأكسدة ، يتحول المعدن إلى كاتيون ، والذي يقع في المحلول الذي توجد فيه اللوحة. لهذا السبب ، يبدأ محلول الأنود في تقديم تركيز أعلى من الكاتيونات (Y+). في هذه الحالة ، لوحظ انخفاض في صفيحة الأنود المعدنية.
Y → و- + ص+
بعد ذلك ، تنتقل الإلكترونات المفقودة أثناء أكسدة معدن لوحة الأنود عبر السلك الكهربائي الخارجي وتنتقل إلى اللوحة المعدنية الموجودة في الكاثود. وهكذا ، فإن اللوحة الموجودة في الكاثود تصبح مشحونة بالإلكترونات.
-
الكاتيونات الحالية (C+) في المحلول تتحرك باتجاه لوحة الكاثود لأنها مشحونة بالإلكترونات. تصبح الكاتيونات ، عند اكتساب الإلكترونات الموجودة في اللوحة ، محايدة (مستقرة وصلبة) وتلتصق بها. لهذا السبب ، يقدم محلول الكاثود تركيزًا أعلى للأنيونات من الكاتيونات. في هذه الحالة ، لوحظ زيادة في حجم الصفيحة المعدنية الكاثودية.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
ج+ + و- → ج
من فهم كيف كومة دانييل، من الممكن ملاحظة أن المحلول الموجود في الأنود يتلقى كمية أكبر من الكاتيونات Y+ بسبب أكسدة معدن الصفيحة X. من ناحية أخرى ، فإن المحلول الموجود في الكاثود يفقد كاتيوناته (C+) لأنهم يعانون من انخفاض في البلاك.
حول هذه المسألة بالتحديد يتم تسليط الضوء على عمل جسر الملح. تتمثل الوظيفة الرئيسية لهذا الجسر في تعزيز توازن الشحنات الموجودة في كل من حلول القطب الموجب والكاثود. في جسر الملح ، لدينا دائمًا ملح (عادة كلوريد البوتاسيوم أو نترات الأمونيوم) مفككًا في الماء. شاهد تمثيل المعادلة في جسر الملح:
WZ + H.2O → W.+ + ض-
في جسر الملح ، هناك نوعان من الأيونات (W+ و Z-) ، والتي يتم تحويلها إلى القطب السالب والأنود وفقًا لـ:
ال) الأنود يستقبل الأنيونات (Z-) الموجود في جسر الملح بسبب أكسدة العنصر (Y) ، مما يؤدي إلى زيادة كمية الكاتيونات (Y+) في الحل.
ب) يستقبل الكاثود الكاتيونات (W+) من جسر الملح لأنه أثناء تشغيل البطارية ، الكاتيون (C+) الموجود في الحل يتم تقليله على السبورة. وبالتالي ، يحتوي محلول الكاثود على كمية أكبر من الأنيونات (N.-) وبالتالي يتلقى الكاتيون الموجود في جسر الملح.
بي ديوغو لوبيز دياس
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
DAYS ، ديوغو لوبيز. "جسر الشراع" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. تم الوصول إليه في 28 يونيو 2021.
