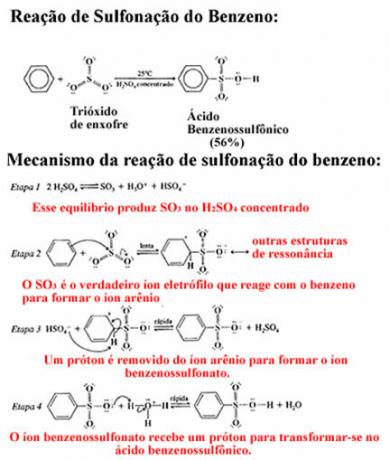
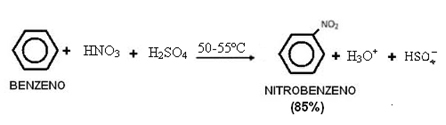
الأحماض هي المواد التي يتأين في وسط مائي وهي جيدة الموصلات قوة. يمكن قياس حموضة مادة ما باستخدام تقنيات قياس الجهد الأيوني للهيدروجين (الرقم الهيدروجيني) من حل. تستخدم بعض طرق تحليل الأس الهيدروجيني مؤشرات مثل عباد الشمس أو الفينول فثالين ، والتي تعكس قيمة الرقم الهيدروجيني للمحلول في اللون.
يمكن وصف الأحماض:
من خلال وجود أو عدم وجود الأكسجين في جزيءه ؛
بالقوة؛
بواسطة الهيدروجين المؤين
من خلال تقلبها.
اقرأ أيضا:مقارنة بين الأحماض والقواعد - الاختلافات والخصائص
خصائص الأحماض
تتأين في وسط مائي ، وتطلق الكاتيون H.+.
هم موصلات للكهرباء بسبب الافراج عن الأيونات في وسط مائي.
في اتصال مع البيئة الأساسية ، فإنهم يعانون تفاعل التعادل، وتشكيل الملح والماء كنتاج لهذا التفاعل.
يغيرون لون المحلول في وجود مادة مؤشر مثل عباد الشمس أو الفينول فثالين.
النكهة الحامضة للليمون والبرتقال وغيرها من الفواكه الحمضية ترجع إلى الحمض الموجود في هذه الأطعمة.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
إمكانات الهيدروجين (pH)
جهد أيون الهيدروجين (pH) هو عملية حسابية تعبر عن تركيز أيون هيدروجين في بعض المحلول. لتحديد الرقم الهيدروجيني وتحليل الوسط ، يؤخذ في الاعتبار ما يلي:
قانون أوستوالد للتخفيف (كلما كان مخففًا ، ستتكون المزيد من الأيونات في المحلول) ؛
تأين الماء (Kw) ، وهو الانهيار الطبيعي لجزيء H.2O في H أيونات+ وأوه-;
الماء المقطر عند 25 درجة مئوية لديه تأين تلقائي Kw = 10-14 ونفس تركيز أيونات H+ وأوه-، أي أنها وسيلة محايدة.
لحساب الأس الهيدروجيني الذي يتضمن تركيز الهيدروجين+, استعمال: الرقم الهيدروجيني = -log [H.+].
إعلم أن:
الرقم الهيدروجيني> 7 ← الحل الأساسي
الرقم الهيدروجيني <7 → محلول حمضي
الرقم الهيدروجيني = 7 أو الرقم الهيدروجيني = pOH → محلول محايد
نرى أيضا: ما هي الصيغ الحمضية مثل؟

تصنيف الأحماض
ال التصنيف الحمضي يمكن القيام به مع الأخذ بعين الاعتبار أربعة معايير مختلفة.
درجة التأين (α) أو قوة الحمض
α = عدد الجزيئات المتأينة
عدد الجزيئات الذائبة
أحماض قوية: α ≥ 50%.
مثال: áحامض كبريتية (ح2فقط4) → α = 61%.أحماض شبه قوية أو معتدلة: 5% < α < 50%.
مثال: حامض الفوسفوريك (H3غبار4) → α = 27%.أحماض ضعيفة: α ≤ 5%.
مثال: حمض البوريك (H3بو3) → α = 0,075%.
→ عدد الهيدروجين المؤين
أحادي: تطلق كاتيون H+.
مثال: áحامض هيدروكلوريك (HCL) ؛
حمضي: يطلق اثنين من الكاتيونات H+.
مثال: كبريتيد الهيدروجين (H2س).ترياسيد: يطلق ثلاثة كاتيونات H+.
مثال: حمض البوريك (H3بو3).تتراسيد: يطلق أربعة كاتيونات H+.
مثال: حمض البيروفوسفوريك (H4ص2ا7).
انتباه! في حالة الهيدروجين ، كل الهيدروجين في الجزيء قابل للتأين ؛ ولكن في حالة الأوكسجين ، فقط الهيدروجين المرتبط بذرة الأكسجين قابل للتأين. مثال على ذلك هو حمض الهيبوفوسفور (H3غبار2) ، وهو أحادي الحمض لأنه على الرغم من وجود ثلاثة هيدروجين في تركيبته ، إلا أنه يطلق الهيدروجين المرتبط بـ الأكسجين.
→ وجود الأكسجين
الأوكسجين: تحتوي على أكسجين في بنيتها.
مثال: حمض هيبوكلوروس (HO Cl).
هيدراكيدز: لا تحتوي على أكسجين في بنيتها.
مثال: حمض الهيدروفلوريك (HF).
→ التقلب
مثبت: نقطة الغليان(قدم) > 100 درجة مئوية ، وتتحول ببطء إلى حالة غازية.
مثال: حامض الكبريتيك (H2فقط4) → PE = 340 درجة مئوية.متطايرة: نقطة الغليان <100 درجة مئوية ، تتغير بسرعة وسهولة إلى الحالة الغازية.
مثال: كبريتيد الهيدروجين (H2S) → PE = -59.6 درجة مئوية.
التسمية الحمضية
→ هيدراكيدز
حمض + اسم الأنيون + مائي
لجميع الأحماض ، يستخدم المصطلح "حمض" قبل التسمية التي تميز الجزيء. في hydracids ، يتم استبدال اللاحقة "eto" من اسم العنصر بـ "hydric".
أمثلة:
حمض الهيدروكلوريك → حامض الكلورمائي
HBr → حامض بروممائي
HF → حامض الفلورمائي
→ الأوكسجين
تختلف تسمية الأوكسجين باختلاف رقم الأكسدة (NOX) للعنصر المركزي. انظر الجدول أدناه:
أكاسيد النيتروجين للعنصر المركزي |
التسمية الحمضية |
||
اختصار- |
-أقحم- |
-suffix |
|
+1 و +2 |
فرس النهر- |
-اسم البريق- |
-OSO |
+3 و +4 |
-- |
اسم أنيون- |
-OSO |
+5 و +6 |
-- |
اسم أنيون- |
-ic |
+7 |
لكل |
-اسم البريق- |
-ic |
أمثلة:
HClO → مع العلم أن الهيدروجين (H) يحتوي عادةً على أكاسيد النيتروجين +1 والأكسجين (O) يحتوي على أكاسيد النيتروجين - 2 ، لكي يكون لدينا جزيء 0 شحنة ، يجب أن يحتوي الكلور (Cl) على أكاسيد النيتروجين +1 ، لذا فإن تسمية هذا الحمض هي حمض تحت الكلور.
HNO2 → حمض النيتروز
HClO4 →áحامضبيركلوريك
→ استثناءات من القاعدة
H2CO3 → حمض الكربونيك ، وليس كربونيًا ، كما هو الحال في ظل قاعدة أكاسيد النيتروجين.
ح3بو3 → áحامض بوريك، وليس ثقوب.
الأحماض في الحياة اليومية
الأسمدة والأدوية: حامض الفوسفوريك (H3غبار4) يستخدم على نطاق واسع في صناعة الأسمدة وكذلك كدواء. إنه أحد الأحماض العديدة المستخدمة في المجال الصيدلاني.
الحمضيات: لديك حامض الاسكوربيك (C.6ح8ا6) ، المعروف أيضًا باسم فيتامين سي.
خل: له في تكوينه حمض الاسيتيك (CH3COOH).
- المياه الفوارة والمشروبات الغازية: يتكون من حمض الكربونيك (H2كو3) ، مما يعطي المنتج إحساسًا بالانتعاش.
الوصول أيضًا إلى:دور الأحماض في المشروبات الغازية

تمارين حلها
السؤال رقم 1 - (Enem) يمكن استخدام العصير المستخرج من الملفوف الأحمر كمؤشر على الصفة الحمضية (الرقم الهيدروجيني بين 0 و 7) أو القاعدية (الرقم الهيدروجيني بين 7 و 14) للحلول المختلفة. عن طريق خلط القليل من عصير الملفوف مع المحلول ، يبدأ الخليط في إظهار ألوان مختلفة ، وفقًا لطبيعته الحمضية أو الأساسية ، وفقًا للمقياس أدناه.

تم اختبار بعض الحلول باستخدام هذا المؤشر ، مما أدى إلى النتائج التالية:

وفقًا لهذه النتائج ، فإن الحلول الأول والثاني والثالث والرابع لها على التوالي الصفة التالية:
أ) حمضية / قاعدية / قاعدية / حمضية.
ب) حمض / قاعدي / حامض / قاعدي.
ج) قاعدية / حمضية / قاعدية / حمضية.
د) حمض / حمض / قاعدي / قاعدي.
هـ) أساسي / أساسي / حمض / حمض.
القرار
البديل E. لتحديد ما إذا كانت المادة ذات طابع حمضي أو أساسي أو حتى محايد ، يتم إجراء تحليل للألوان التي تم الحصول عليها في الاختبار فيما يتعلق ببيانات المقياس المحدد. مع العلم أن المحاليل ذات الرقم الهيدروجيني = 7 محايدة ، وأن الرقم الهيدروجيني> 7 أساسي وأن الرقم الهيدروجيني <7 حمضي ، فإننا نصل إلى استنتاج أن الأمونيا وحليب المغنيسيا من المواد الأساسية ، والخل وحليب البقر الأحماض.
السؤال 2 - (PUC-Camp) فيما يتعلق بالمواد المسماة بالأحماض ، لاحظ الطالب الخصائص التالية:
أنا - لدي قوة تآكل.
II - قادرة على تحييد القواعد ؛
ثالثًا - تتكون من عنصرين كيميائيين ؛
رابعا- تكوين المحاليل المائية التي تجري التيار الكهربائي.
لقد ارتكب أخطاء فقط في
أ) الأول والثاني
ب) الأول والثالث
ج) الأول والرابع
د) الثاني والثالث
هـ) الثالث والرابع
القرار
البديل ب. ليست كل الأحماض أكالة ، فقط الأحماض القوية ، ويمكن أن تتكون الأحماض من ذرتين أو أكثر.
بواسطة Laysa Bernardes
مدرس كيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
ARAúJO ، Laysa Bernardes Marques de. "أحماض" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/acidos.htm. تم الوصول إليه في 27 يونيو 2021.