لحدوث تفاعل كيميائي ، من الضروري تلبية أربعة شروط أساسية ، وهي:
1. يجب الاتصال الكواشف ؛
2. يجب أن يكون هناك تقارب كيميائي بين الكواشف ؛
3. يجب أن تكون التصادمات بين جزيئات الكاشف فعالة ؛
4. يجب الوصول إلى طاقة التنشيط.
انظر بإيجاز إلى كل حالة:
1.الاتصال بين الكواشف:
هذه الحالة واضحة ، لأنه حتى لو كانت المواد المتفاعلة لديها الكثير من الألفة لبعضها البعض ، كما في حالة الأحماض والقواعد ، إذا تم فصلها ، فلن يحدث التفاعل. يجب أن تتلامس حتى يمكن أن تتصادم جزيئاتها ، وتكسر روابط المواد المتفاعلة وتشكل روابط المنتجات.

2.التقارب الكيميائي:
كما رأينا ، فإن توصيل الكواشف أمر ضروري ، لكنه ليس كافياً. على سبيل المثال ، إذا وضعنا الصوديوم في الماء ، فسيحدث تفاعل عنيف للغاية ، ولكن إذا وضعنا الذهب ، فلن نرى أي فرق. وذلك لأن المواد المختلفة لها روابط كيميائية مختلفة مع بعضها البعض ، أو قد لا يكون لها أي تقارب على الإطلاق. كلما زاد التقارب الكيميائي ، زادت سرعة التفاعل.
في الأمثلة المذكورة ، للصوديوم تقارب كبير مع الماء ، لدرجة أنه من أجل عدم ملامسته للرطوبة في الهواء ، يتم تخزين الصوديوم المعدني في الكيروسين. الذهب خامل ، ولهذا السبب تدوم آثار الذهب لفترة طويلة ، مثل توابيت مصر.

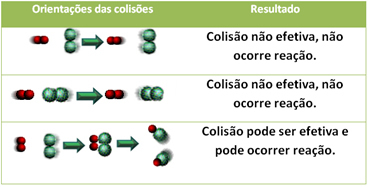
3.نظرية الاصطدام:
حتى في المركبات التي لها صلة كيميائية ، لكي يستمر التفاعل ، من الضروري أن تتصادم جزيئاتها أو ذراتها أو جزيئاتها بشكل فعال. ليس كل الجسيمات التي تصطدم تفعل ذلك بشكل فعال ، ولكن الصدمات التي تؤدي إلى كسر روابط الكاشف وتشكيل روابط جديدة هي تلك التي تحدث في الاتجاه الصحيح ومع الطاقة كافية.
الموضح أدناه هو حالة تصادمين غير فعالين وتصادم واحد فعال يؤدي إلى حدوث رد فعل.
4.طاقة التنشيط والمركب المنشط:
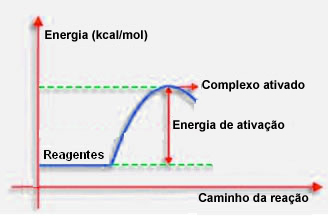
كما هو مذكور في البند السابق ، فإن الاصطدام الفعال ، بالإضافة إلى التوجيه الإيجابي ، يحتاج أيضًا إلى طاقة كافية. يُطلق على الحد الأدنى من الطاقة اللازمة لكل تفاعل حدوث طاقة التنشيط.
إذا كانت المواد المتفاعلة تحتوي على طاقة مساوية أو أكبر من طاقة التنشيط ، أثناء الصدمة الموجهة بشكل جيد ، سيتشكل معقد منشط في البداية ، وهو هيكل وسيط بين المواد المتفاعلة و منتجات. في المركب المنشط ، توجد روابط كاشف ضعيفة وتشكل روابط منتج جديد.
وبالتالي ، تعمل طاقة التنشيط كنوع من الحاجز لحدوث التفاعل ، لأنه كلما زاد حجمه ، زاد صعوبة حدوث التفاعل. في بعض الحالات ، من الضروري توفير الطاقة للكواشف. على سبيل المثال ، غاز الطهي له صلة بالتفاعل مع الأكسجين الموجود في الهواء ، لكننا نحتاج إلى توفير الطاقة عندما نجمع المطابقة معًا ، وإلا فلن يحدث التفاعل. ولكن بمجرد أن يبدأ التفاعل نفسه يطلق طاقة كافية لتنشيط الجزيئات الأخرى والحفاظ على استمرار التفاعل.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm


