في دراسة علم الحرارة نسميها التحولات الثابتة تلك التحولات الغازية حيث لا يوجد تبادل حراري مع البيئة الخارجية. لذلك ، في التحول الأديباتي ، تكون الحرارة صفرًا.
س = 0
إذا طبقنا القانون الأول للديناميكا الحرارية ، فلدينا:
س = ∆U + τ
∆U = - τ
ولكن ماذا يعني عدم وجود تبادل حراري بين البيئة الخارجية؟ هذا يعني أنه في حالة حدوث تمدد غازي وأدى الغاز وظيفة 300 J ، فإنه لا يحدث إذا كان هناك تبادل حراري مع الوسيط ، فإن تغير الطاقة الداخلية للغاز سيكون سالبًا ، وبالتالي ، سيكون لدينا:
∆U = -300J
الآن ، إذا كان هناك انخفاض في الطاقة الداخلية للغاز ، فيمكننا القول أنه كان هناك أيضًا انخفاض في درجة حرارة الغاز. القانون العام للغازات

يمكننا القول أنه إذا زاد الحجم وانخفضت درجة حرارة الغاز ، فإن ضغط الغاز سينخفض بالضرورة أيضًا. بشكل عام ، يمكننا القول أن نفس الشيء يحدث مع الضغط ، لأنه إذا كان هناك ضغط ، فإن الطاقة الداخلية للغاز ستزداد ، وبالتالي سيزداد الضغط أيضًا.
الخريطة الذهنية: التحول الأديباتي
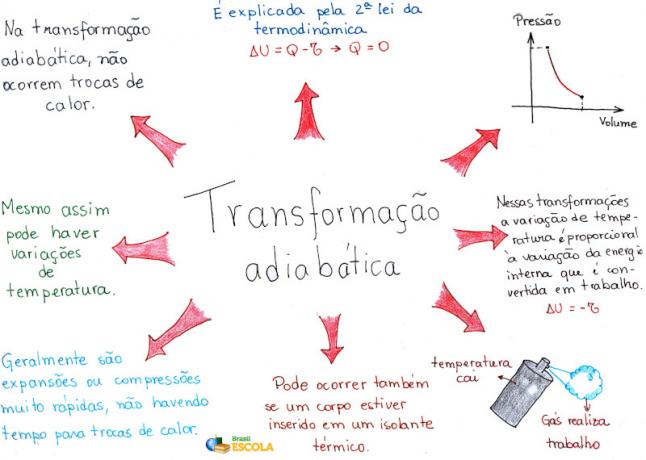
* لتنزيل الخريطة الذهنية بصيغة PDF ، انقر هنا!
باختصار يمكننا القول:
- في تمدد ثابت الحرارة ، تنخفض درجة الحرارة والضغط ؛
- في ضغط ثابت الحرارة ، تزداد درجة الحرارة والضغط.
يعطينا الرسم البياني أدناه نظرة عامة على التحول الحافظ للحرارة:
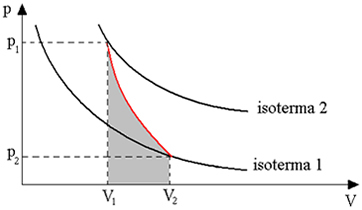
يتم الحصول على التحولات الأديباتية باستخدام حاويات معزولة حراريًا ، أو أيضًا من خلال الضغط أو التمدد السريع جدًا.
وبالتالي ، يمكننا أن نستنتج أنه عندما يتبادل الغاز الحرارة مع البيئة الخارجية ، فإن الحرارة تستغرق بعض الوقت لتنتشر عبر الكتلة الغازية وتصل إلى حالة توازن. لذلك ، عند تنفيذ كل من التمدد والضغط السريع ، لا يوجد عمليًا تبادل حراري مع البيئة الخارجية.
* خريطة ذهنية بواسطتي. رافائيل هيلربروك
بقلم دوميتيانو ماركيز
تخرج في الفيزياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm
