ال ثابت التحلل المائي (خ) يشير إلى أ التوازن الكيميائي تم إنشاؤه من التحلل المائي لملح (تفاعل كيميائي يتضمن ملحًا وماءًا قابلين للذوبان).
باعتباره ثابتًا لأي توازن آخر ، فإن التعبير عن ثابت التحلل المائي يتكون من ناتج تركيزات المنتج مقسومة على ناتج تركيزات الكاشف ، على النحو التالي:
خ = [منتجات]
[الكواشف]
يتضمن العمل مع ثابت التحلل المائي معرفة ثلاث ظواهر مهمة:
- تفكك الأملاح;
- تأين الماء
- تحلل الملح.
تفكك الأملاح
عندما يضاف ملح قابل للذوبان إلى الماء ، فإنه يتفكك ويطلق كاتيون غير الهيدرونيوم (H +) وأنيون غير الهيدروكسيل (OH-).

لتذكيرك عندما يكون الملح قابل للذوبان في الماء أو غير قابل للذوبان ، انقر هنا ودراسة جدول الذوبان في الملح.
تأين الماء
الماء مادة تخضع بشكل طبيعي لظاهرة التأين الذاتي ، أي أنها تنتج كاتيون الهيدرونيوم وأنيون الهيدروكسيل.
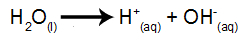
معادلة تأين الماء
التحلل المائي للملح
كملح قابل للذوبان يطلق الأيونات في الماء ويخضع الماء للتأين ، مما ينتج عنه الأيونات في الوسط ، يمكن أن يحدث التفاعل (التحلل المائي) بين أيونات الملح وأيونات الماء. عندما يحدث هذا التفاعل ، فإن التفاعلات المحتملة هي:
- كاتيون الملح مع أنيون الماء (تكوين قاعدة) ؛
- أنيون الملح مع كاتيون الماء (تكوين ملح) ؛
تحدث التفاعلات المذكورة أعلاه فقط إذا كانت القاعدة أو الحمض المتكون ضعيفًا.
شاهد مثالاً على التحلل المائي لملح:
→ التحلل المائي لهيبوكلوريت الأمونيوم (NH4ClO)
عندما يضاف هيبوكلوريت الأمونيوم إلى الماء ، فإنه يذوب وينفصل ، ويطلق أيونات الأمونيوم (NH4 +) وأنيون الهيبوكلوريت (ClO-):

معادلة توضح الأيونات المنبعثة في تفكك هيبوكلوريت الأمونيوم
نظرًا لأن الماء ، عند خضوعه للتأين ، ينتج H + و OH- ، لدينا في المحلول كاتيونات واثنين من الأنيونات ، والتي يمكن أن تتفاعل. يتفاعل NH4 + الكاتيون فقط مع OH- أنيون لأنه يشكل قاعدة ضعيفة (NH4OH). يتفاعل ClO- أنيون فقط مع H + كاتيون لأنه يشكل حمض ضعيف (HClO).

معادلة توازن التحلل المائي لهيبوكلوريت الأمونيوم
بناء التعبير عن ثابت التحلل المائي
يعتمد تكوين ثابت التحلل المائي للملح بشكل حصري على معادلة التحلل المائي لذلك الملح. أدى التحلل المائي لهيبوكلوريت الأمونيوم ، على سبيل المثال ، الذي تم العمل عليه في العنصر السابق ، إلى إنشاء المعادلة التالية:

معادلة توازن التحلل المائي لهيبوكلوريت الأمونيوم
كيف نبني التعبير عن ثابت التحلل المائي يأخذ في الاعتبار المنتجات والكواشف ، فإن تعبير الثابت سيكون:
خ = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
ملاحظة: لا يشارك الماء في المعادلة لأنه كاشف سائل وأيضًا لأنه الوسيلة الأساسية لحدوث التحلل المائي ، أي أنه ثابت.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
