يحدث التحول متساوي الضغط عندما يكون الغاز عند ضغط ثابت. على سبيل المثال ، إذا تم إجراؤه في بيئة مفتوحة ، فسيكون التحول متساوي الضغط حيث سيكون الضغط ضغطًا جويًا لن يتغير.
في هذه الحالة ، تختلف درجة الحرارة والحجم. درس اثنان من كبار العلماء كيفية حدوث هذا الاختلاف في التحولات متساوية الضغط. أول من ربط حجم ودرجة حرارة الغازات كان جاك تشارلز (1746-1823) ، في عام 1787 ، ثم في عام 1802 ، حدد جوزيف جاي-لوساك (1778-1850) هذه العلاقة كمياً.
وهكذا ، ظهر قانون يشرح التحولات متساوية الضغط للغازات ، والتي أصبحت تُعرف باسم قانون تشارلز / جاي-لوساك. جاء على النحو التالي:
"في نظام الضغط الثابت ، يتناسب حجم الكتلة الثابتة للغاز طرديًا مع درجة الحرارة."

هذا يعني أنه إذا ضاعفنا درجة الحرارة ، فإن الحجم الذي يشغله الغاز سيتضاعف أيضًا. من ناحية أخرى ، إذا خفضنا درجة الحرارة ، سينخفض حجم الغاز أيضًا بنفس النسبة.
يمكن ملاحظة ذلك في تجربة بسيطة للغاية. إذا وضعنا بالونًا في عنق الزجاجة ، فسيتم احتجاز كتلة ثابتة من الهواء. إذا غمسنا هذه الزجاجة في وعاء من الماء المثلج ، فإن البالون سينكمش. الآن ، إذا وضعناها في وعاء من الماء الساخن ، سيمتلئ البالون.
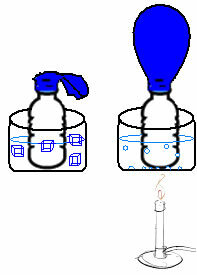
هذا لأنه مع زيادة درجة الحرارة ، تزداد الطاقة الحركية لجزيئات الغاز وتزداد أيضًا السرعة التي تتحرك بها. وهكذا يتمدد الغاز ويزيد الحجم الذي يشغله وينفخ البالون. يحدث العكس عندما نخفض درجة الحرارة ونضعها في الماء البارد.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
يتم إعطاء هذه العلاقة بين درجة الحرارة والحجم في التحولات متساوية الضغط من خلال العلاقة التالية:
الخامس = ك
تي
"k" ثابت ، كما يتضح من الرسم البياني التالي:
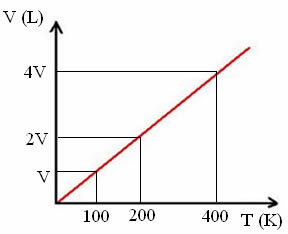
لاحظ أن نسبة V / T تعطي دائمًا ثابتًا:
_الخامس_ =_2V_ = _4 فولت_
100 200 400
وبالتالي ، يمكننا إنشاء العلاقة التالية للتحولات متساوية الضغط:
الخامسمبدئي = الخامسنهائي
تيمبدئي تينهائي
هذا يعني أنه عند حدوث أي تغير في درجة حرارة الغاز عند ضغط ثابت ، يمكننا إيجاد حجمه باستخدام هذا التعبير الرياضي. والعكس صحيح أيضًا ، بمعرفة حجم الغاز ، نكتشف درجة حرارته. شاهد مثالاً:
"الكتلة الغازية تحتل حجم 800 سم3 عند -23 درجة مئوية ، عند ضغط معين. ما هي درجة الحرارة المسجلة عندما تشغل الكتلة الغازية ، عند نفس الضغط ، حجم 1.6 لتر؟ "
القرار:
البيانات:
الخامسمبدئي = 800 سم3
تيمبدئي = -23 درجة مئوية ، إضافة إلى 273 لدينا 250 كلفن (كلفن)
الخامسنهائي = 1.6 لتر
تينهائي = ?
* أولاً علينا ترك الحجم على نفس الوحدة. من المعروف أن 1 dm3 يساوي 1 لتر. مثل 1 dm3 هو نفس 1000 سم3يبدو أن 1 لتر = 1000 سم3:
1 لتر 1000 سم3
× 800 سم3
س = 0.8 لتر
* الآن نستبدل قيم الصيغة ونجد القيمة النهائية لدرجة الحرارة:
الخامسمبدئي = الخامسنهائي
تيمبدئي تينهائي
0,8_ = 1,6
250 تنهائي
0.8 تنهائي = 250. 1,6
تينهائي = 400
0,8
تينهائي = 500 ألف
* بالانتقال إلى مقياس مئوية ، لدينا:
T (K) = T (° C) + 273
500 = T (درجة مئوية) + 273
T (درجة مئوية) = 500 - 273
T (درجة مئوية) = 227 درجة مئوية
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تحويل متساوي الضغط" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. تم الوصول إليه في 27 يونيو 2021.
ما هي الغازات ، ما هي خواص الغازات ، المركبات الجزيئية ، الانضغاطية ، الحجم الثابت ، الطاقة الحركية يعني ، درجة حرارة مطلقة للغاز ، غاز مثالي ، غازات حقيقية ، غاز كامل ، متغيرات حالة الغاز ، حجم غاز ، مواسم
كيمياء

قوانين جاي-لوساك ، قانون بروست ، التفاعل الكيميائي ، النسب الثابتة ، كتل المواد ، المادة النقية ، التحليل النوعي والكمي ، قانون الغازات المثالية ، قانون النسب الثابتة ، قانون النسب المحددة ، القانون الحجمي.