يُطلق على أحد أكبر التحديات التي يواجهها أي شخص يتعلم الكيمياء التوزيع الإلكتروني. ما سنقدمه في هذا السياق يمكن أن يسهل بشكل كبير دراساتك المتعلقة بتكوين الإلكترون الذي اقترحه العالم لينوس بولينج.
يتم تحديد الحد الأقصى لعدد الإلكترونات التي تناسب كل طبقة أو مستوى طاقة من خلال الجدول:
طبقة مستوى الطاقة الحد الأقصى لعدد الإلكترونات
1 ك 2
2 لام 8
الثالث م 18
الرابعة شمال 32
5 ° س 32
السادسة ص 18
7 س 8
الترتيب المتزايد للطاقة للمستويات الفرعية هو الترتيب في تسلسل الأقطار. يظهر مخطط Linus Pauling أدناه:
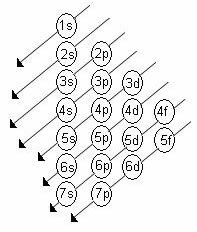
القواعد الاساسية:
1. يشير الرقم الذري (Z) للعنصر ، في الحالة المحايدة ، إلى عدد الإلكترونات المراد توزيعها. يتم تمثيل هذا الرقم في الجزء الأيسر السفلي من رمز العنصر.
2. باستخدام مخطط Pauling ، ابدأ في توزيع الإلكترونات من أعلى إلى أسفل ، مع مراعاة الترتيب المتزايد للطاقة (الموجه حسب اتجاه الأسهم).
3. املأ المستويات الفرعية بأقصى مستوى للإلكترونات. إذا كان مستوى فرعي معين يحتوي على 6 إلكترونات فقط ، فلا تتجاوز هذا المقدار.
4. تحقق من عدد الإلكترونات عن طريق جمعها في كل مستوى فرعي.
دعونا نضعها موضع التنفيذ؟
وزع إلكترونات ذرة الحديد (Z = 26).
إذا كان العدد الذري 26 ، فهذا يعني أنه في ذرة الحديد العادية يوجد 26 إلكترونًا. بتطبيق مخطط بولينج ، سيكون لدينا:

بقلم ليريا ألفيس
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm
