الايزومرات النشطة أو الأيزومرات النشطة بصريًا (IOA) هي جزيئات مادة كيميائية معينة يمكنها تنفيذ استقطاب وانحراف المادة خطة ضوء يمينًا أو يسارًا. للتحقق مما إذا كانت المادة تحتوي على أيزومرات نشطة أم لا ، فقط تحقق مما إذا كان هناك كربون غير متماثل في صيغته الهيكلية:

بتحليل السلسلة الممثلة في الصورة أعلاه ، يمكننا أن نرى أن يحتوي الكربون المركزي على أربعة روابط مختلفة (أوه ، ح ، تش3 و Cl) ، مما يجعلها أ كربون غير متماثل، ويسمى أيضًا الكربون غير متناظر. وبالتالي ، عندما تحتوي سلسلة على واحد أو أكثر من الكربون اللولبي ، سيكون هناك أيزومرات نشطة.
أنت أنواع الايزومرات النشطة(IOA) هم انهم:
أيمن: ايزومر بصري نشط ينحني الضوء المستقطب إلى اليمين ؛
ليفوجيرو: ايزومر بصري نشط ينحني الضوء المستقطب إلى اليسار.
ملاحظة: يشير وجود الكربون غير المتماثل في الصيغة الهيكلية إلى أن المادة يجب أن تحتوي على أيزومر مسدود وأيزومر ديكستروتوري. لا يعود الأمر إلينا لمعرفة الاتجاه الذي ينحرف به الضوء ، حيث إن وجود الكربون اللولبي يثبت بالفعل هذه الحقيقة. دائمًا ما يكون نصف الجزيئات الموجودة أعسر والنصف الآخر أعسر.
تتمتع جزيئات اليد اليمنى واليسرى لأي مادة عضوية دائمًا بنفس الخصائص الفيزيائية (نقطة الذوبان ، نقطة الغليان ، الكثافة ، الذوبان ، إلخ.) ، لكن الأنشطة الكيميائية الحالية (السلوك في الكائن الحي) العديد من الاختلافات. مثال على ذلك هو الأدرينالين. يعمل جزيء الأدرينالين فقط في الجسم ، بينما لا يعمل جزيء dextrorotatory.
شاهد الآن الصيغة البنائية لمادة البيوتان 2-ol للتحقق مما إذا كانت تحتوي على أيزومرات نشطة أم لا:
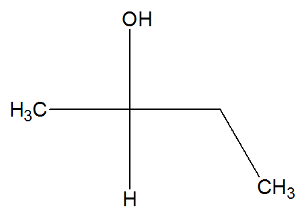
يمكننا أن نلاحظ ، في بنية البيوتان -2 ، أن الكربون 2 يحتوي على أربعة مجلدات مختلفة (أوه ، ح ، تش3، CH2-CH3) ، لذلك فهو كربون مراوان و يقدم أيزومر نشط dextrorotatory وأيزومر نشط آخر ليفوروتاري.
حساب الايزومرات النشطة (IOA)
الكيميائي الهولندي جاكوبوس هنريكوس فانت هوف طورت صيغة تسمح بحساب عدد الأيزومرات النشطة (IOA) التي يمكن لمادة معينة تقديمها. نظرة:
IOA: 2لا
ن: هو عدد الكربونات اللولبية في الصيغة التركيبية للمادة.
اتبع مثالين لتطبيق صيغة Vant't Hoff:
5-ثنائي كلورو -2،3-ثنائي هيدروكسي-هكسانيديويك أسيد

في الصيغة الهيكلية للمركب ، هناك ثلاثة الكربون مراوان أو غير متماثل ، لذلك:
IOA = 2لا
IOA = 23
IOA = 8
2،3،4،5-رباعي هيدروكسي هكسانال

في الصيغة الهيكلية للمركب ، هناك أربعة الكربون مراوان (السهام الحمراء) أو غير متماثل ، لذلك:
IOA = 2لا
IOA = 24
IOA = 16
ملاحظة: هناك احتمال أن تحتوي الصيغة الهيكلية على نوعين من الكربون غير المتماثل لهما نفس الروابط. إذا حدث هذا ، فإننا نعتبر في الحسابات 1 فقط لقيمة n ، وليس 2. شاهد مثالاً:
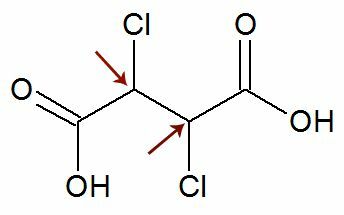
يحب اثنين من الكربون مراوان هم انهم يساوي, نحن نعتبر واحدًا فقط الكربون في الحساب:
IOA = 2لا
IOA = 21
IOA = 2
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm
